下图是甲、乙两位同学一起在实验室进行的氢氧化钠与盐酸中和反应的实验。
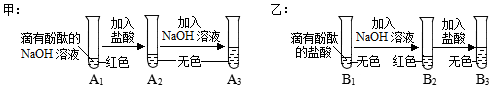
(说明:图中
、
、
、
、
、
均为溶液编号)
根据上图实验,请你与甲、乙同学一起完成下列探究:
| 探究环节 |
甲同学的探究 |
乙同学的探究 |
| 提出问题 |
溶液为什么不变红? |
溶液中溶质成分是什么?(酚酞不计) |
| 作出猜想 |
实验过程中,酚酞变质了。 |
猜想一: 猜想二: 、 |
| 实验验证 |
(1)取少量
溶液于另一试管中,向其中滴加
溶液,溶液变红,说明甲同学的猜想(填"成立"或"不成立")。 (2)你认为,在常温下 溶液测出的 应(填">"、"="或"<")7。 |
取少量
溶液加入盛有少量铁粉的试管中,观察到有无色气泡产生,固体逐渐减少,溶液由无色变为。据此,你认为乙同学的猜想(填"一"或"二")成立。 |
| 交流反思 |
(1)甲、乙同学的实验中,反应均涉及到的化学方程式是。 (2) 溶液未变红,你认为原因是 溶液中较多,加入的 溶液未将其完全中和。 (3)甲、乙同学经过实验对比探究,一致认为做化学实验时应注意药品用量的控制。 |
类比法是化学研究物质的重要方法之一。草酸(H2C2O4)的化学性质与碳酸相似,受热分解后得到三种氧化物。某兴趣小组对草酸的有关性质进行探究。
【提出猜想】猜想一:草酸也能使紫色石蕊试液变______色;
猜想二:三种氧化物可能是CO2、CO和__________(填化学式),该猜想的依据是_________________。
【查阅资料】1、无水硫酸铜是一种白色粉末,遇水变成蓝色。
2、向氯化钯溶液中通入CO,会产生黑色沉淀。
【实验探究】兴趣小组为验证猜想二,将草酸受热后得到的气体,依次通过下图中的A、B、C装置。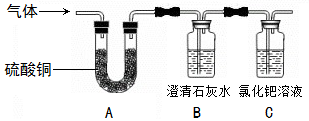
【实验结论】当观察到装置A中变蓝、B中变浑浊、C中__________________的实验现象时,证明猜想二是正确的。写出B中发生反应的化学方程式__________________________________________________。
【实验反思】①根据实验结论,从环保角度考虑,实验中应对尾气进行处理。处理方法是_________________。
②草酸受热分解的化学方程式为_____________________________________________________。
(6分)某兴趣小组围绕“燃烧条件”这一主题开展如下探究活动,请你参与:
【实验内容】
①用棉花分别蘸酒精和水,放在酒精灯火焰上加热片刻,观察现象。
②取一小块乒乓球碎片和滤纸碎片,分别用坩埚钳夹住,放在酒精灯火焰上加热,观察到两种物质都能燃烧。③从乒乓球和滤纸上各剪下一小片(同样大小),如图所示分别放在一片薄铜片的两侧,加热铜片的中部,观察现象。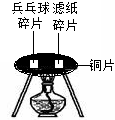
【分析讨论】
(1)进行实验①时,如果在酒精灯上加热时间较长,蘸水的棉花球也会燃烧起来,其原因是________。
(2)进行实验②的目的是为了证明__________________________。
(3)实验③看到的现象是,这两个对比实验说明,燃烧__________________________________。
【反思与应用】
(4)乒乓球的材料名叫赛璐璐。它是由胶棉、增塑剂、染料等加工而成的塑料,燃烧会生成二氧化氮等有毒气体。为了保护我们的地球,废弃兵乓球最佳的处理方式是_________________________。
小红和她的同学学习了金属活动性及稀硫酸的一些性质后,对铜与浓硫酸能否发生反应产生了兴趣,并进行了如下探究:
【提出问题】猜想Ⅰ:铜与浓硫酸不能反应;
猜想Ⅱ:铜与浓硫酸能反应,且可能生成氢气。
【实验探究】实验Ⅰ:在一支试管中加入一小片铜,再加入少量的浓硫酸,放置一段时间,试管中无现象;
实验Ⅱ:再给上述试管加热,试管中产生有刺激性气味的气体,将反应后的溶液小心地注入到盛有少量水的烧杯中,溶液呈现出明显的蓝色。
【分析猜想】(1)溶液呈蓝色,说明生成了
(2)根据实验现象及已有的知识推断,产生的气体不可能是氢气,很可能是一种含硫元素的气体。
【查阅资料】(1)常见的含硫元素的气体有二氧化硫和硫化氢。
(2)二氧化硫和二氧化碳相似,都能和氢氧化钠等碱溶液反应生成盐和水。
(3)二氧化硫能使品红溶液褪色,加热,又能恢复原来的红色。硫化氢不能使品红溶液褪色。
(4)二氧化硫和硫化氢均有毒。
【实验探究】为了检验产生的有刺激性气味的气体的成分,小红和她的同学进一步实验:将产生的气体通入品红溶液中,品红溶液褪色,加热,溶液又恢复了红色。
【实验结论】(1)在常温下,铜与浓硫酸不能反应。
(2)在加热条件下铜与浓硫酸反应产生的气体是,此反应还生成了水,请写出该反应的化学方程式;
(3)浓硫酸与铜加热时能反应,而稀硫酸与铜即使加热也不能反应,由此说明:物质的化学性质除了与物质本身的性质有关外,还可能与溶液中溶质的有关。
【拓展延伸】为了防止污染空气,小红和她的同学采用氢氧化钠溶液来吸收多余的气体,请写出该反应的化学方程式。
氯化铁溶液能与铜反应生成可溶性的氯化铜和氯化亚铁,工业上常用此原理生产印刷线路板。以下是印刷线路板的生产及废液的处理过程: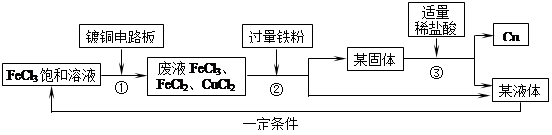
请回答下列问题:
(1)步骤②③中实验操作的名称是。步骤②实验操作前发生了两个反应:2FeCl3+Fe = 3FeCl2和,
(2)某固体的成分有。
(3)步骤③中适量稀盐酸的标志是;发生反应的化学方程式是。
(4)该流程中可以循环、回收利用的物质是。
甲、乙、丙、丁四位同学在探究实验时发现了个意外的现象:氢氧化钠溶液中滴入酚酞试液,溶液变成红色,可是过了一会儿红色就消失了。这是什么原因呢?他们依据所学的化学知识,分别对意外现象的成因做了如下猜想:
甲:可能是酚酞变质造成的;
乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故;
丙:可能是酚酞与空气中的氧气反应使红色消失;
丁:可能是氢氧化钠溶液的浓度过高引起的;
(1)甲同学刚提出自己的猜想,就遭到其余三位同学的否定,三位同学的理由是:;
(2)丙同学认为乙同学的猜想也不正确,他的理由是
(3)四位同学讨论后认为要验证丙同学的猜想,还需作如下实验,你知道其实验目的吗?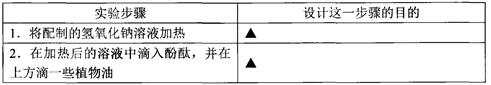
通过以上实验,四位同学观察到的现象是:溶液先变成红色,过了一会儿红色仍然消失。
(4)若丁同学的猜想正确,大家能设计实验证明吗?