用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1 ;平衡常数为K1 ;
2N2(g)+CO2(g)+2H2O(g)=CH4(g)+4NO(g) ΔH=+1160 kJ·mol-1 ;平衡常数为K2 。
请回答下列问题:
(1)反应CH4 +2NO2 N2+CO2+2H2O(g) 的平衡常数K= (用K1、K2表示)。
N2+CO2+2H2O(g) 的平衡常数K= (用K1、K2表示)。
(2)若用标准状况下4.48LCH4还原NO2至N2 ,整个过程中转移的电子总数为 (阿伏伽德罗常数用NA表示),放出的热量为 kJ。
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:FeSO4+Na2CO3="==" FeCO3↓+Na2SO4FeCO3+C6H8O7="==" FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1. 1 |
3. 2 |
| Al3+ |
3. 0 |
5. 0 |
| Fe2+ |
5. 8 |
8. 8 |
(1)制备FeCO3时,选用的加料方式是 (填字母),原因是 。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。①铁粉的作用是 。②反应结束后,无需过滤,除去过量铁粉的方法是 。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是 。
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3 ) 出发,先制备绿矾,再合成柠檬酸亚铁。请结合右图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应, ,得到FeSO4溶液, ,得到FeSO4·7H2O 晶体。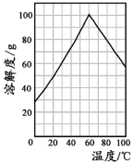
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下:
提示:在本实验条件下,Ni(Ⅱ)不能被氧化,高锰酸钾的还原产物是MnO2
回答下列问题:
(1)反应②中除掉的杂质离子是 ,发生反应的离子方程式为
加高锰酸钾溶液前,若pH较低,对除杂的影响是
(2)反应③的反应类型为 ,过滤得到的滤渣中,除了过量的锌外还有
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2 .取干操后的滤饼11.2g,煅烧后可得到产品8.1 g. 则x等于 。
有增长碳链是有机合成中非常重要的反应。例如:
反应①
用 通过以下路线可合成(Ⅱ):
通过以下路线可合成(Ⅱ):
(1)(Ⅰ)的分子式为 ;1mol该物质完全燃烧需要消耗 mol O2.。
(2)(Ⅱ)与足量的热NaOH溶液反应的化学方程式为 。
(Ⅲ)的结构简式为 ; 在生成(Ⅲ)时,还能得到另一种副产物C6H8O4,该反应的化学方程式为 ,该反应的反应类型是 。
在生成(Ⅲ)时,还能得到另一种副产物C6H8O4,该反应的化学方程式为 ,该反应的反应类型是 。
(4)对二氯苯 也能与有机物(Ⅰ) (过量)发生类似反应①的系列反应,其生成有机物的结构简式为 。
也能与有机物(Ⅰ) (过量)发生类似反应①的系列反应,其生成有机物的结构简式为 。
课题组以甲苯为主要原料,采用以下路线合成化妆品防霉剂:对—羟基苯甲酸乙酯。

请回答:
(1)有机物C7H7Br的名称为 。
(2)产品的摩尔质量为 。
(3)在①~⑥的反应中属于取代反应的有 。
(4) 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) 。
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) 。
(5) 的同分异构体很多,其中符合下列条件有 种。
的同分异构体很多,其中符合下列条件有 种。
①遇到FeCl3溶液出现显色现象;②能发生水解反应;③能发生银境反应;④无-CH3结构。上述同分异构体中核磁共振氢谱显示其有5种峰的结构简式为 。
(6)高分子化合物 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)。注:合成路线的书写格式参照如下示例流程图:
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)。注:合成路线的书写格式参照如下示例流程图:
。
肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体。
(1)肉桂酸甲酯由C、H、O三种元素组成,质谱分析其分子的相对分子质量为162,核磁共振氢谱谱图显示有6个峰,其面积之比为1:2:2:1:1:3,利用红外光谱仪检测其中的某些基团,测得红外光谱如下图:
则肉桂酸甲酯的结构简式是 (不考虑立体异构)
(2)已知:
I.醛与醛能发生反应,原理如下:
Ⅱ.已知烃A在标准状况下的密度为1.25g.L-1。合成肉桂酸甲酯的工业流程如下图所示:
请回答:
①化合物J的结构简式为 ;
②化合物G中的官能团有 ;
③G→H为 反应(填反应类型);
④写出反应D→E的化学方程式 ;
H→I的反应 (填“能”或“不能”)改用酸性高锰酸钾溶液,简述理由: 。
⑤符合下列条件的I的同分异构体共有5种。写出另两种同分异构体的结构简式:
A.能发生水解反应
B.与银氨溶液作用出现光亮的银镜
C.能与溴发生加成