Ⅰ、亚硫酸钠中的硫元素为+4价,请选择下面所提供的化学试剂,设计简单的实验,证明亚硫酸钠既有氧化性,又有还原性。(所提供的试剂为:溴水、硫化钠溶液、亚硫酸钠溶液、稀硫酸、NaOH溶液、氨水)
(1)要说明Na2SO3具有氧化性,应选用的试剂是 ,观察到的现象是 。
(2)要说明Na2SO3具有还原性,应选用的试剂是 ,反应的离子方程式是_______________。
Ⅱ、某亚硫酸钠试剂已被部分氧化。为了确定它的纯度,要进行如下实验:
①称取样品 a g;
②将样品溶解;
③在溶液中加入稍过量的盐酸酸化的BaCl2溶液;
④将沉淀过滤,洗涤、干燥后称重,质量为b g。
试回答:
(1)BaCl2溶液要用盐酸酸化的原因是 ;
(2)BaCl2溶液要稍过量的原因是 ;
(3)判断沉淀是否洗尽的方法是 ;
(4)Na2SO3样品纯度的计算式是 。
III、现有混有少量SO2杂质的CO2气体,请选用适当的实验装置,收集纯净干燥的CO2气体。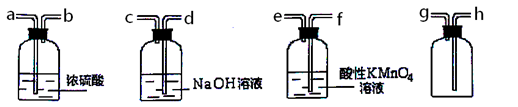
①要达到实验目的,按气流从左到右,各接口连接顺序正确的是_______。
A.dcabh B.feabh C.feabg
②本实验除去SO2的原理是利用SO2的________性质。
某研究性学习小组设计实验方案制备氯化铜并验证次氯酸的漂白性。
已知氯化铜遇水蒸气潮解。
|
 __________。
__________。
 _。
_。
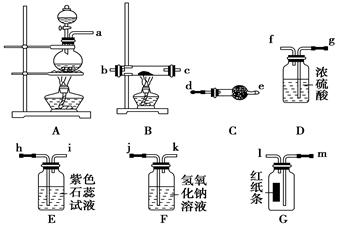
某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置F中发生反应的离子方程式是。
(2)装置A中的烧瓶内固体可选用(选填以下选项的代号)。
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从右图的备选装置中选择,并将编号填入下列空格。B、D、E。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为: ;装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体就是氯化铵:。
;装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体就是氯化铵:。
(5)若从装置C和G处逸出的尾气中含有N2和少量C12,应如何处理?。
苯甲酸甲酯是一种重要的工业原料,有机化学中通过酯化反应和水解反应的原理,可以进行苯甲酸甲酯的合成和皂化反应。有关物质的物理性质见下表所示:
| 苯甲酸 |
甲醇 |
苯甲酸甲酯 |
|
| 熔点/℃ |
122.4 |
-97 |
-12.3 |
| 沸点/℃ |
249 |
64.3 |
199.6 |
| 密度/g.cm-3 |
1.2659 |
0.792 |
1.0888 |
| 水溶性 |
微溶 |
互溶 |
不溶 |
Ⅰ.苯甲酸甲酯的合成和提纯
相关的实验步骤为:
第一步:将过量的甲醇和苯甲酸混合加热发生酯化反应
第二步:水洗提纯
第三步:蒸馏提纯
|
(1)上述是合成和提纯的有关装置图,请写出合成和提纯苯甲酸甲酯的操作顺序(填字
母) 。 G H I
G H I
科学研究发现纳米级的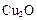 可作为太阳光分解水的催化剂。
可作为太阳光分解水的催化剂。
Ⅰ.四种制取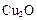 的方法
的方法
(1)火法还原。用炭粉在高温条件下还原CuO;
(2)用葡萄糖 还原新制的
还原新制的 。写出化学方程式;
。写出化学方程式;
(3)电解法。反应为 。则阳极产物是;
。则阳极产物是;
(4)最新实验研究用肼( )还原新制
)还原新制 可制备纳米级
可制备纳米级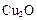 ,同时放出
,同时放出 。该制法的化学方程式为。
。该制法的化学方程式为。
Ⅱ.用制得的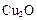 进行催化分解水的实验
进行催化分解水的实验
(1)一定温度下,在2L密闭容器中加入纳米级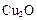 并通入0.10mol水蒸气,发生反应:
并通入0.10mol水蒸气,发生反应: ;△H= +484kJ/mol,不同时段产生
;△H= +484kJ/mol,不同时段产生 的量见下表:
的量见下表:
| 时间/min |
20 |
40 |
60 |
80 |
| n(O2)/mol |
0.0010 |
0.0016 |
0.0020 |
0.0020 |
计算:前20min的反应速率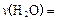 ;达平衡时,至少需要吸收的光能为kJ。
;达平衡时,至少需要吸收的光能为kJ。
(2)用以上四种方法制得的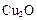 在某相同条件下分别对水催化分解,产生氢气的速率v随时间t变化如图所示。下列叙述正确的是。
在某相同条件下分别对水催化分解,产生氢气的速率v随时间t变化如图所示。下列叙述正确的是。
A.c、d方法制得的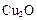 催化效率相对较高 催化效率相对较高 |
B.d方法制得的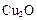 作催化剂时,水的平衡转化率最高 作催化剂时,水的平衡转化率最高 |
C.催化效果与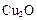 颗粒的粗细、表面活性等有关 颗粒的粗细、表面活性等有关 |
| D.Cu2O催化水分解时,需要适宜的温度 |
某校化学小组学生利用下图所示装置进行“乙二酸(俗名草酸)晶体受热分解”的实验,并验证分解产物中有CO2和CO(图中夹持装置已略去)。 (1)装置C的作用是 _______,装置E的作用是。
(1)装置C的作用是 _______,装置E的作用是。
(2)乙二酸受热分解的反应方程式是。
(3)①证明分解产物中有CO2的现象是 _______________________。
②证明分解产物中有CO的现象是__ ______。
(4)该装置有一个不足之处,请写出弥补这个不足之处的理由和具体方法:_____________ __________ __________。