元素R、X、T、Z、Q在元素周期表中的相对位置如图所示, 其中T单质和H2在光照的条件下发生爆炸。则下列判断正确的是
| A.五种元素中Z的活动性最弱,T 的氧化物对应水化合物酸性最强 |
| B.氢化物的稳定性:R>Q>X;R>T>X |
| C.Q单质能从溶液中置换出X单质,R单质能从溶液中置换出T单质 |
| D.X阴离子和T阴离子相比,半径:X阴离子的大;还原性:T阴离子的强 |
下列离子方程式书写正确的是
| A.用氨水吸收足量的CO2气体:OH-+CO2 = HCO3 |
| B.向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O= CaSO3↓+2HClO |
| C.淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O = 4OH- +2I2 |
| D.常温下铁与浓硫酸作用:2Fe + 12H+ + 3SO42— = 2Fe3+ + 3SO2↑+6 H2O |
下列各组物质按右图所示转化关系每一步都能一步实现的是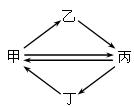
| 甲 |
乙 |
丙 |
丁 |
|
| A |
Cl2 |
HCl |
HClO |
NaCl |
| B |
Si |
Na2SiO3 |
H2SiO3 |
SiO2 |
| C |
NO |
HNO3 |
NO2 |
NH3 |
| D |
SO2 |
SO3 |
H2SO4 |
S |
设NA代表阿伏加德罗常数的数值。下列说法中正确的是
| A.0.1 mol二氧化硅晶体中含硅氧键数目为0.4 NA |
| B.标准状况下,10 g D2O所含的中子数为4 NA |
| C.常温常压下,4.4 g C3H8中含非极性键数为0.2NA |
| D.1 mol Cl2与足量NaOH溶液反应,转移电子数为2 NA |
已知由三种元素构成的四种物质存在下列反应,其中a的分子空间构型为正四面体。组成a分子的两种元素的原子序数和小于10,组成b分子的元素为第三周期的元素。则下列判断正确的是
| A.四种分子中的化学键均是极性键 | B.a、c分子中中心原子均为sp3杂化 |
| C.四种分子中既有σ键,又有π键 | D.b、d分子中共价键的键能b大于d |
已知氨气分子和甲烷分子的空间构型分别为三角锥形和正四面体,造成这一差异的主要原因是
| A.两种分子中心原子的杂化类型不同 |
| B.两种分子中键的极性和分子的极性不同 |
| C.NH3分子中存在有一对未成键的孤对电子 |
| D.氨气分子之间和甲烷分子之间的作用力类型不同 |