X、Y、T、Q 四种元素,位于元素周期表前四周期,元素的性质或结构信息见下表。
| 元素 |
性质或结构信息 |
| X |
单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼。 |
| Y |
二价阳离子的外围电子层排布为3d9 |
| T |
原子核外s轨道电子总数等于p轨道电子总数;人体内含量最多的元素,且其单质是常见的助燃剂。 |
| Q |
第三周期主族元素中原子半径最小。 |
请根据上述信息回答下列问题:
(1)写出 X3- 的一种等电子体的化学式 ;X的气态氢化物易液化的原因: 。
(2)写出T元素基态原子的核外电子排布图 ;Q元素的原子核外有 种运动状态不同的电子。
(3)元素 X 、T 的电负性相比, 的小(填元素名称);元素 X 的第一电离能与T相比较,T的 (填“大”或“小”)。
(4)甲醛(CH2O)分子中σ 键与π 键的个数之比为 。
(5)Y元素在周期表中位于 区。Y单质晶体的晶胞如图所示,该晶胞中实际拥有 个原子,该晶体中Y原子在三维空间里的堆积方式为 堆积。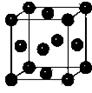
(6)在Y的硫酸盐溶液中通入X的气态氢化物至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。此蓝色沉淀溶解的离子方程式为: 。
(7)元素X与Q可形成化合物XQ3,根据价层电子对互斥理论判断XQ3的空间构型为: ,分子中X原子的杂化方式为 杂化。
溴有“海洋元素”之称,海水中溴含量为65 mg·L-1。实验室模拟海水中溴的提取。
实验方法:将适量新制氯水加入到20 mL富含溴离子的海水中(海水可以用0.1 mol·L-1的NaBr溶液代替),把溴置换出来。氯水中的氯气作________________剂,涉及反应的离子方程式为__________________。
得到的单质溴可以用有机溶剂在________(仪器)中实现萃取富集,萃取试剂用________、苯等,得到的有机层显________色。
海水的综合利用可以制备金属镁,其流程如下图所示:
(1)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。__________________________
(2)实验室将粗盐制成精盐的过程中,溶解、过滤、蒸发三个步骤的操作都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
①溶解:________________。
②过滤:__________________________。
③蒸发:________________。
钛(Ti)因为具有神奇的性能越来越引起人们的关注。常温下,钛不和非金属、强酸反应;红热时,却可与常见的非金属单质反应。钛是航空、军工、电力等方面的必需原料。地壳中含钛矿石之一称金红石(TiO2)目前大规模生产钛的方法是:
第一步:金红石、碳粉混合,在高温条件下通入氯气制得TiCl4和一种可燃性气体。该反应的化学方程式是______________________,该反应的还原剂是________。
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。
(1)此反应的化学方程式是__________________。
(2)简述由上述所得产物中获取金属钛的步骤______________。
如图所示: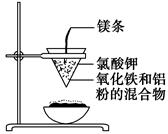
用两张圆形滤纸分别折叠成漏斗状,套在一起,使四周都有四层。把内层滤纸取出,在底部剪一个小孔,用水润湿,再跟另一纸漏斗套在一起,架在铁圈上,下面放置一盛沙的蒸发皿。把5 g干燥的氧化铁粉末和2 g铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条。观察发生的现象。通过以上实验信息,回答下列问题:
(1)写出该反应的化学方程式:__________,
在该反应中________是氧化剂,________是还原剂,该反应称为________反应。
(2)选出该实验的实验现象(填写在横线上):________。
①镁条剧烈燃烧;②放出大量的热,并发出耀眼的光芒,火星四射;③纸漏斗的下部被烧穿;④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体。
(3)写出下列操作或物质的作用:内层纸漏斗底部剪一个孔:________;蒸发皿盛沙:________;镁条:________;氯酸钾:________。
钛是一种活泼金属,具有密度小、熔点高、可塑性强、机械强度高等性能。工业上常用硫酸分解铁钛矿石来制备二氧化钛,用以冶炼钛,主要有以下五个反应:
①FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
②TiOSO4+2H2O=H2TiO3↓+H2SO4
③H2TiO3 TiO2+H2O
TiO2+H2O
④TiO2+2C+2Cl2 TiCl4↑+2CO↑
TiCl4↑+2CO↑
⑤TiCl4+2Mg 2MgCl2+Ti
2MgCl2+Ti
(1)针对以上五个反应,下列叙述错误的是________。
A.反应①是非氧化还原反应
B.反应②生成了两种酸
C.反应④中的TiO2是氧化剂
D.反应⑤表现了金属镁比金属钛的还原性强
(2)钛具有很强的耐腐蚀性,以下对其原因的分析正确的是________。
A.钛是像金、铂一样的不活泼金属
B.金属钛的表面易形成致密的氧化膜
C.钛与氧气、酸等腐蚀剂不反应
D.钛有很高的强度