草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为:
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是 。
【设计、完成实验】(1)称取 g草酸晶体(H2C2O4·2H2O),配置500 mL 0.10 mol/L H2C2O4溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和 。
②下列操作会使所配溶液浓度偏低的是 (填下列选项的字母序号)。
| A.称取草酸晶体时,将草酸晶体放在托盘天平右盘 |
| B.定容时俯视刻度线 |
| C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水 |
| D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容 |
(2)完成探究,记录数据
| 实验 编号 |
烧杯中所加试剂及用量(mL) |
控制条件 |
溶液褪色时间(s) |
|||
| 0.10 mol/L H2C2O4溶液 |
等浓度 KMnO4溶液 |
H2O |
0.50 mol/L 稀硫酸 |
|
|
|
| 1 |
30 |
20 |
30 |
20 |
|
18 |
| 2 |
30 |
20 |
30 |
20 |
水浴控制温度65 ℃ |
15 |
| 3 |
30 |
20 |
30 |
20 |
加入少量MnSO4固体 |
3.6 |
| 4 |
30 |
20 |
x |
20 |
加入5 mL 0.10 mol/LK2SO4溶液 |
18 |
则x = ,假设2成立
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定。取10.00 mL 0.10 mol/L H2C2O4溶液于锥形瓶中,加入10 mL 0.50 mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为: 。上述实验中KMnO4溶液的物质的量浓度为 。
图中的实验装置可用于制取乙炔.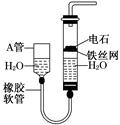
请填空:
(1)图中,A管的作用是___________________________________________________________,
制取乙炔的化学方程式是______________________________________________________.
(2)乙炔通入KMnO4酸性溶液中观察到的现象是______________________________,乙炔发生了________反应.
(3)乙炔通入溴的CCl4溶液中观察到的现象是______________________________,乙炔发生了________反应.
(4)为了安全,点燃乙炔前应______________________,乙炔燃烧时的实验现象是________________________________________________________________________.
某同学设计如图所示的实验装置来粗略测定电石中碳化钙的质量分数。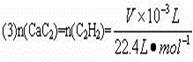
(1)烧瓶中发生反应的化学方程式主要是_________________________________。装置B和C的作用是_______________________________________________。烧瓶要干燥,放入电石后应塞紧橡皮塞,这是为了____________________________________________________。
(2)所用的电石质量不能太大,否则____________;也不能太小,否则____________。若容器B的容积为250 mL,则所用的电石质量应在____________g左右(从以下数据选填:0.30、0.60、1.00、1.50、2.00)(气体体积以标准状况计)。
(3)实验中测得排入量筒中水的体积为V mL(以标准状况计),电石质量为m g,则电石中碳化钙质量分数是____________(不计算导管中残留的水,气体中饱和水蒸气也忽略不计)。
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如下图。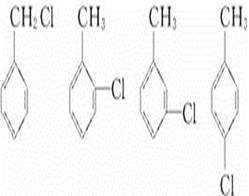
加热聚丙烯废塑料得到的产物如下表:
| 产物 |
氢气 |
甲烷 |
乙烯 |
丙烯 |
苯 |
甲苯 |
碳 |
| 质量分数(%) |
12 |
24 |
12 |
16 |
20 |
10 |
6 |
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。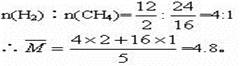
写出反应②③的化学方程式________、________。
(2)试管B收集到的产品中,能使高锰酸钾酸性溶液褪色的物质,其一氯化物有________种。
(3)锥形瓶C中观察到的现象________________。经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为________。
(4)写出C中逸出的气体在工业上的两种用途________、________。
实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:
C2H5—OH+HBr C2H5Br+H2O
C2H5Br+H2O
已知反应物的用量为:0.30 mol NaBr(s);0.25 mol C2H5OH(密度为0.80 g·cm-3);36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1);25 mL水。试回答下列问题。
(1)该实验应选择图中的a装置还是b装置?_____________。
(2)反应装置中的烧瓶应选择下列哪种规格最合适()
A.50 mL B.100 mL C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是 ()
A.A进B出 B.B进A出 C.从A进或B进均可
(4)可能发生的副反应为:_______________、________________、________________
(至少写出3个方程式)。
(5)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是________________。
某化学课外小组所做实验的示意图如下图
 |
 图中“”表示气体流向,M是一种子纯净而干燥的气体,Y为另一种气体。当与M气体反应时y气体过量,E内有棕色气体产生。实验所用到的物质只能由下列物质中选取:Na2CO3、Na2O2 、NaCl、CaCl2、(NH4)2CO3碱石灰等固体及蒸镏水。据此实验,完成下列填空:
图中“”表示气体流向,M是一种子纯净而干燥的气体,Y为另一种气体。当与M气体反应时y气体过量,E内有棕色气体产生。实验所用到的物质只能由下列物质中选取:Na2CO3、Na2O2 、NaCl、CaCl2、(NH4)2CO3碱石灰等固体及蒸镏水。据此实验,完成下列填空:
(1)A中所用装置的主要仪器有
(2)B中所选的干燥剂是 ,作用是。
(3)C中发生的主要反应的化学方程式是
(4)制取y气体的D装置所用的主要仪器是
制取y的化学方程式是 。
(5)当F中为紫色石蕊试液时,见到的现象是 主要
反应方程式
为 、。