有机物A由碳、氢、氧三种元素组成。现取2.3 g A与2.8 L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重2.7 g,碱石灰增重2.2 g。回答下列问题:
(1)2.3 g A中所含氢原子、碳原子的物质的量各是多少?(4分)
(2)通过计算确定该有机物的分子式。(4分)
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体多少升?(设反应中HNO3被还原成NO)
(10分)有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
(1)甲取样品①,反应后的溶液中铁只以Fe3+离子的形式存在,则样品①的质量为g。
(2)乙取样品②,反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量(设为ag)范围是。
(3)丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应过程中溶液里Fe3+、Fe2+、NO3—三种离子中的两种离子的物质的量的变化曲线如下图所示,则该曲线表示的是
物质的量变化的曲线,请你在此图中再画出另外种离子的物质的量的变化曲线。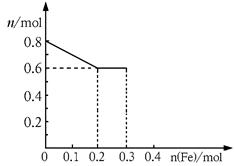
(8分)将一定量的氧化铜加入到100.Og质量分数为19.6%的硫酸溶液中,完全溶解后溶液显蓝色,再加人19.6g铁粉充分反应后,经过滤、干燥得到的固体仍为19.6g。
(1)通过计算说明干燥后的固体是什么物质?
(2)求原氧化铜的质量。
将固体草酸锰MnC2O4·2H2O放在一个可以称出质量的容器中加热。固体质量随温度的变化关系如图所示。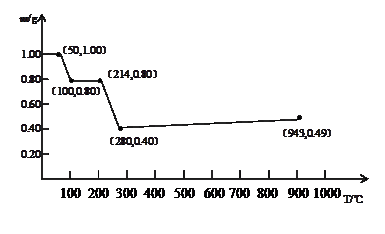
(1)214℃,剩余固体的成分为(填写化学式,下同);280℃时,剩余固体的成分为。
(2)当温度超过280℃时,剩余固体的质量又会增加,943℃完全生成另一种固体物质,则280℃-943℃过程中发生反应的化学方程式为。
(3)草酸锰受热可生成MnO2,MnO2是一种重要的无机功能材料,在硫酸锰溶液中加入NaClO可生成MnO2和Cl2,请写出向硫酸锰溶液中加入NaClO时发生反应的化学方程式。
现有碳酸氢钠和碳酸钠固体混合物,为了测定混合物中碳酸钠的百分含量,利用如下装置: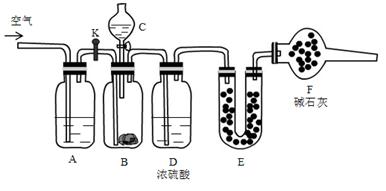
实验步骤:
①检查装置气密性
②将药品装好,其中B中装入 9.5g样品,E装好药品后,称量总质量56.0g
③关闭活塞K,打开分液漏斗活塞,放下液体,充分反应
④待B中完全反应后,打开活塞K,通入一会儿空气
⑤称量E装置质量为60.4 g
回答下列问题:
(1)C中装的药品是,E中药品是,F中药品的作用。
(2)A中发生反应的离子方程式为。
(3)样品中碳酸钠的质量百分含量为。
(4)若实验中后期不通入空气,则所测得样品中碳酸钠的百分含量(填“偏小”“偏大”“不影响”)