(每空2分)(共12分) 实验室可用酒精、浓硫酸作试剂来制取乙烯,但实验表明,还有许多副反应发生,如反应中会生成SO2、CO2、水蒸气等无机物。某研究性学习小组欲用下图所示的装置制备纯净的乙烯并探究乙烯与单质溴能否反应及反应类型。回答下列问题:
(1)写出制备乙烯反应的化学方程式:__________,实验中,混合浓硫酸与乙醇的方法是将_______慢慢加入另一种物质中;加热F装置时必须使液体温度__________________________。
(2)为实现上述实验目的,装置的连接顺序为F→________________→D。(各装置限用一次)
(3)当C中观察到________时,表明单质溴能与乙烯反应;若D中________________,表明C中发生的是取代反应;若D没有出现前面所描述的现象时,表明C中发生的是加成反应。
)X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,一般情况下X的单质只有氧化性。
(1)写出实验室制取W2反应的离子方程式 。
(2)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究YX2和W2的性质。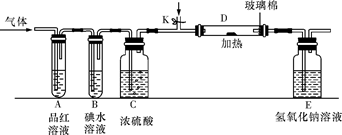
①分别通入YX2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”) ;若装置D中装的是铁粉,当通入W2时D中观察到的现象为 ;若装置D中装的是五氧化二钒,当通入YX2时,打开K通入适量X2,化学反应方程式为 ;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,则该反应的化学方程式为 。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母) ,可以看到白色沉淀生成。
| A.氨水 | B.稀盐酸 |
| C.稀硝酸 | D.氯化钙 |
(4)若由元素Y和X组成-2价酸根Z,Z中Y和X的质量比为Y∶X=4∶3,当W2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出W2与Z的溶液完全反应产生浅黄色沉淀的离子方程式
(1)下面A~F是中学化学实验中常见的几种仪器:
A.坩埚 B.容量瓶 C.试管 D.托盘天平 E.玻璃棒
① 其中仪器上标示出仪器的使用温度的 __________(填写编号);
②称取 10.5 g固体样品(1 g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为____ g.
(2)若要配制500mL 1mol/L NaOH溶液时,下列哪些操作会使实验结果偏高的是,偏低,无影响。(填写编号)
A.定容,振荡,摇匀溶液后,发现液面低于刻度线,再补加水
B.称量时,固体放在右盘,砝码放在左盘(未使用游码)
C.原容量瓶洗涤后未干燥
D.定容时俯视刻度线
E.移液时,未洗涤烧杯和玻璃棒
F.在烧杯中溶解NaOH固体后,未冷却立即将溶液注入容量瓶中
2005年的诺贝尔化学奖颁给了3位在烯烃复分解反应研究方面做出突出贡献的化学家。烯烃复分解反应实际上是在金属烯烃络合物的催化下实现C=C双键两边基团换位的反应。如下图表示了两个丙烯分子进行烯烃换位,生成两个新的烯烃分子——丁烯和乙烯。
现以石油裂解得到的丙烯为原料,经过下列反应可以分别合成重要的化工原料I和G。I和G在不同条件下反应可生成多种化工产品,如环酯J。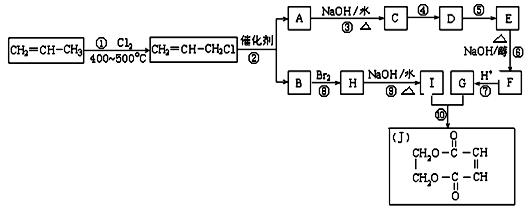
请按要求填空:
(1) 写出下列反应的反应类型:
①______________,⑥______________,⑧______________。
(2) 反应②的化学方程式是___________________________________________。
(3) 反应④、⑤中有一反应是与HCl加成,该反应是________(填反应编号),设计这一步反应的目的是_____________________________________________,
物质E的结构简式是_______________________。
(4) 反应⑩的化学方程式是___________________________________________。
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl2反应生成的是KClO3。写出在温度较高时KOH 与Cl2反应的化学方程式
,当反应中转移5 mol电子时,消耗的氯气是mol。
(2)在反应液I中加入KOH固体的目的是(填编号)。
| A.与反应液I中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供碱性的环境 |
| D.使KClO3转化为 KClO |
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为。
(4)如何判断K2FeO4晶体已经洗涤干净。
实验室制取SO2的反应原理为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
(1)这些装置的连接顺序(按气体左右的方向)是→→
→→→→→(填各接口的编号)。
(2)实验时甲橡皮管的作用与原理是。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是。
(4)Ⅳ处观察到的现象是。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会(填“增大”“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为。