老师用下图所示装置为同学们做了一个兴趣实验。已知装置B、C、D中依次盛有紫色石蕊试液、足量的澄清石灰水和稀盐酸。小资料:HCl气体极易溶于水。
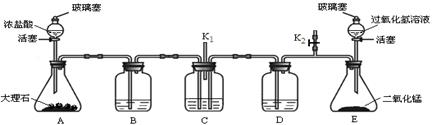
(1)打开A中的玻璃塞和活塞,B中实验现象是 。B中的现象不能说明二氧化碳与水反应的原因是 。C中的化学反应的方程式是 。
(2)一段时间后,关闭A中的活塞和玻璃塞,打开弹簧夹K2及E中的玻璃塞和活塞,待足量的过氧化氢溶液流入锥形瓶后,立即关闭E中的活塞,并用弹簧夹K2夹紧橡皮管。C中可能出现的现象是 ,解释C中呈现的现象的原因是 。
(3)将A中产生的气体通入过量的NaOH溶液中,为了确定反应后的溶液中含有NaOH 的实验方法为 。
二甲醚是重要的有机中间体,利用二氧化碳加氢合成二甲醚能变废为宝,且可替代汽油作为新型清洁燃料。
(1)常温常压下,二氧化碳加氢可选择性生成二甲醚或一氧化碳:
①CO2 (g)+3H2(g)=CH3OH(l)+H2O(l)△H1 =-55.7 kJ/mol
②2CH3OH(l) = CH3OCH3(g)+H2O (l)△H2 =-23.4 kJ/mol
③CO2 (g)+3H2(g) =CO(g) + H2O (l)△H 3>0
则CO2(g)加氢转化为CH3OCH3(g)和H2O (l)的热化学方程式是___________________________________________________。
(2)合成二甲醚往往选用硅铝混合物作催化剂,硅铝比例不同,生成二甲醚或一氧化碳的物质的量分数不同。下图是硅铝比与产物选择性图:
反应③的平衡常数表达式为,图中A点和B点的平衡常数比较:KA______KB(填“>、=、<”)。根据以上两条曲线,写出其中一条变化规律:___________________。
(3)在280oC时,向一个2L的密闭容器中加入等量2mol二氧化碳和氢气, A点二甲醚的浓度为0.15 mol·L-1,计算在A点二氧化碳的转化率,要求写出计算过程。
(4)二甲醚逐渐发展为替代汽油的清洁燃料,在二甲醚燃料电池中,二甲醚通入______极,碱性条件下,该电极反应式是。
铁是广泛应用的金属。
(1)铁元素在周期表中的位置是,工业上通常采用高炉炼铁的方法制得单质铁,请写出用赤铁矿与CO反应炼铁的化学方程式。
(2)请补充完成实验室制备Fe(OH)3胶体的操作步骤:
①取25ml蒸馏水加热至沸腾
②
③继续煮沸至
④停止加热。
(3)几种离子生成氢氧化物沉淀的pH如下表(已知Fe(OH)2呈絮状,不易从溶液中除去)
注:开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算现有某溶液含有Fe2+、Fe3+、Zn2+、SO42-,要使溶液中的Fe2+和Fe3+完全沉淀,需往溶液中先加入H2O2,作用是,然后再加入NH4HCO3调节pH至 ,NH4HCO3中起调节pH作用的离子是 (填离子符号)
①设计实验探究铁钉和钢钉在碱性溶液中遇到高锰酸钾时是否能发生电化学腐蚀。实验如下
①完成下列表格
②实验2比实验1能够较快看到以上现象的原因是。
二氯化锡是一种重要的电镀原料,又称氯化亚锡。分子式为SnCl2,其沸点为623℃,在水溶液中以SnCl2·2H2O的形式析出。锡的另一种氯化物SnCl4的沸点为114℃。某锡花中(主要成分为锡)含有杂质钡、锑、铜、铅等金属。从锡花中制备二氯化锡晶体工艺如下:
(1)滤渣成分为(用化学式表示)。
(2)经过氯化后的锡主要以SnCl4的形式存在混合液中。写出锡与SnCl4反应的化学方程式。
(3)反应Ⅰ进行反应时,加热反应器使反应液温度升高至600C,开始通入Cl2,随着反应的进行,反应所放出的热量使溶液的温度提高,此时需保持反应温度在80℃~90℃之间,不宜过高。请解释
①温度不宜过高的原因是;
②开始通入氯气时,气体流量不宜过大,随反应的进行逐渐加大氯气的通入量,此操作的目的是。
(4)母液中含有的离子有H+、OH-、。
(16分)用芒硝(Na2SO4·10H2O)制备纯碱、铵明矾[NH4Al(SO4)2·12H2O]的生产工艺流程图如下所示: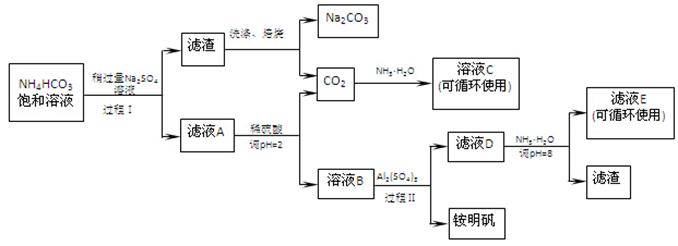
(1)溶液C中的溶质主要是。
(2)铵明矾的溶液呈性,铵明矾可用于净水,用离子方程式说明原理。
(3)过程Ⅰ反应温度不能超过40℃,主要原因是。
(4)运用化学平衡原理解释Na2SO4溶液稍过量的原因
(5)滤液E中溶质离子为
(6)写出工艺流程中焙烧的反应方程式
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
(1)装置B中发生反应的化学方程式是。
(2)装置E中的现象是。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:
(4)该小组利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:滤液(步骤I)→FeCl3溶液(步骤II)→FeCl3·6H2O晶体
①步骤I中通入Cl2的作用是。
②步骤II从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:。③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)________________