(1)实验室用下图所示装置制备少量乙酸乙酯。
①写出制备乙酸乙酯的化学方程式_______________________。
②试管Ⅱ中盛的试剂是____________________________。
③若要把制得的乙酸乙酯分离出来,应采用的实验操作是________。
(2)已知乳酸的结构简式为 。试回答:
。试回答:
①乳酸分子中含有________和_________两种官能团(写名称);
②乳酸与足量金属钠反应的化学方程式为_____________________________;
蛇纹石可以看作由MgO、Fe2O3、Al2O3、SiO2组成。实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
| 氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
1.5 |
3.3 |
9.4 |
实验步骤如下: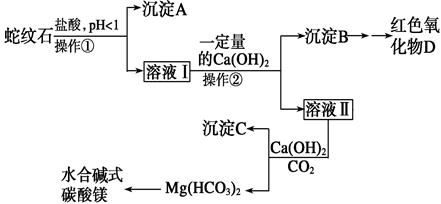
请回答下列问题:
(1)实验室完成操作①所用到的玻璃仪器有________________。
(2)检验溶液Ⅱ中是否含有Fe3+的操作与结论是___________________________
_____________________________________________________________________。
(3)从沉淀混合物B中制取D,应加入一种试剂进行分离,其反应的离子方程式为________________________________________________________________________,
再进行__________、、(依次填写实验操作名称)。
(4)操作②中应控制溶液pH的合理范围是____(填序号)。
| A.小于1.5 | B.1.5~3.3 |
| C.7~8 | D.大于9.4 |
(5)为探究所得的水合碱式碳酸镁[xMgCO3·yMg(OH)2·zH2O]的组成,取样7.28 g于装置A的玻璃管中,请按由左―→右顺序将下列装置连接好(填序号,装置可重复使用):________________________________________________________________________,
装置C应盛的试剂是______________________。
全世界每年被腐蚀损耗的钢铁量非常惊人,在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因。
(1)在潮湿空气中,钢铁发生吸氧腐蚀时的负极反应的电极反应式为_____________。
(2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4  CO↑ + CO2↑ + H2O,
CO↑ + CO2↑ + H2O,
下列装置中,可用作草酸分解制取气体的是______(填答案编号)。
(3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。
①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次可能是_______、
________(填答案编号)。
a.浓硫酸b.澄清的石灰水 c.氢氧化钠溶液d.无水氯化钙
②在点燃C处酒精灯之前应进行的操作是:(a)检查装置气密性;(b)____________。
③E装置的作用是______________________________________________________,
上述装置最后尾气处理的方法是_____________。
④准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n =_____________。
⑤在本实验中,下列情况会使测定结果n偏大的是__________(填答案编号)。
a.缺少装置B b.缺少装置E c.反应后的固体中有少量Fe2O3·nH2O
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。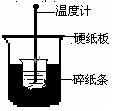
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________。
(2)烧杯间填满碎纸条的作用是_____________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值将_______
(填“偏大”、“偏小”或“无影响”)。
(4)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,
与上述实验相比较,所放出的热量________(填“相等”或“不相等”),但中和热应_________(填“相等”或“不相等”),简述理由________________________________________________________
蛭石为一种层状结构的含镁的铝硅酸盐,是黑云母等天然矿物风化蚀变的产物,因为其受热膨胀时呈挠曲状,形态酷似水蛭,故此得名蛭石。膨化后的蛭石呈颗粒状,有隔热、耐冻、抗菌、防火、吸声等优异性能,但不耐酸。
(1)某硅酸盐矿石的组成可以看作SiO2中有1/4的Si被Al置换,再由Mg平衡其电荷形成的。该矿石的组成以氧化物形式表示为。
(2)某校研究性学习小组取得了某种牌号的膨化蛭石样品,其成分可以用氧化物(MgO、Fe2O3、Al2O3、SiO2、H2O)的形式表示。为研究蛭石的组成,拟进行实验探究,实验流程及相关数据如下:
①固体A的化学式是;
②固体F的物质的量是;
③通过计算,给出用氧化物的形式表示某种膨化蛭石组成的化学式。
用下图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是16.8℃,沸点是44.8℃。已知发生装置中所涉及反应的化学方程式为:
Na2SO3(s)+ H2SO4(85%)=Na2SO4 + SO2↑+ H2O
根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A~E装置中选择最适合Ⅰ、Ⅱ、Ⅲ处连接的装置分别是、、。
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,首先应采取的操作是。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因并说明相应的验证方法(写2点)。
①原因,验证方法
②原因,验证方法
(4)将SO2通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式
(5)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为%(用含a、b的代数式填写)