氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程如下图所示,完成下列填空:
(1)在电解过程中,与电源负极相连的电极上的电极反应式为_____,若检验与电源正极相连的电极上的气体产物,实验室中通常选用的化学试剂是__________。
(2)工业食盐中含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为___________。
(3)如果粗盐中SO42—含量较高,必须添加钡试剂除去,该钡试剂可以是________(选填a、b、c)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为了有效地除去Ca2+、Mg2+、SO42—,加入试剂的合理顺序为_______(选填a、b、c)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、________(填写操作名称)除去NaCl。
碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8
,分子氢原子个数为氧的5倍。
(1)A的分子式是。
(2)A有2个不同的含氧官能团,其名称是。
(3)一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团。
①A的结构简式是。
②A不能发生的反应是(填写序号字母)。
a.取代反应 b.消去反应 c.酯化反应 d.还原反应
(4)写出两个与A具有相同官能团、并带有支链的同分异构体的结构简式:、。
(5)A还有另一类酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,此反应的化学方程式是。(6)已知环氧氯丙烷可与乙二醇发生如下聚合反应: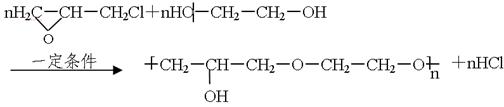
B也能与环氧氯丙烷发生类似反应生成高聚物,该高聚物的结构式是。
某有机化合物
(
)与另一有机化合物
发生如下反应生成化合物
(
):
+
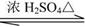 +
+
(1)
是下列化合物之一,已知
不能与
溶液发生显色反应。则
是(填标号字母)。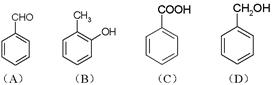
(2)
的分子式是,可能的结构简式是:和。
(3)
有多种同分异构体,其中一种同分异构体
发生银镜反应后,其产物经酸化可得
(
)。
可发生如下反应:
F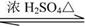
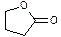 +
该反应的类型是,
的结构简式是。
+
该反应的类型是,
的结构简式是。
(4)若
与
具有相同的碳链,则
的结构简式为:。
现有五种离子化合物
、
、
、
和
,都是由下表中离子形成的:
| 阳离子 |
|
| 阴离子 |
为鉴别它们,分别完成以下实验,其结果是:
a.
和
都不溶于水,也不容于酸;
b.
溶于水后,与上述某阳离子反应可生成
,且
溶液与过量氨水反应生成白色沉淀;
c.
溶于水后,与上述某阳离子反应可生成
,且
溶液与过量氨水反应生成白色沉淀。
d.
溶于水后,与上述某阴离子反应可生成
;
e.
溶液与适量E溶液反应生成沉淀,再加入过量E溶液,沉淀量减少,但不消失。
请根据上述实验结果,填空:
(1)写出化合物的化学式:
,
,
,
。
(2)
溶液与过量的
溶液反应后,最终得到的化学式是。
用
、
、
、
、
、
、
和
分别表示含有18个电子的八种微粒(离子或分子),请回答:
(1)
元素是、
元素是、
元素是(用元素符号表示)。
(2)
是由两种元素组成的双原子分子,其分子式是。
(3)
是所有含18个电子的微粒中氧化能力最强的分子,其分子式是。
(4)
是由两种元素组成的三原子分子,其分子式是,电子式是。
(5)
分子中含有4个原子,其分子式是。
(6)
分子中含有8个原子,其分子式是。
已知
、
、
、
和
5种分子所含原子的数目依次为1、2、3、4和6,且都含有18个电子。又知
、
和
是由两种元素的原子组成。请回答:
(1)组成
分子的原子的核外电子排布式是;
(2)
和
的分子式分别是和;
分子的立体结构呈形,该分子属于分子(填"极性"或"非极性");
(3)若向
的稀溶液中加入少量二氧化锰,有无色气体生成。则
的分子式是,该反应的化学方程式为;
(4)若将1 mol
在氧气中完全燃烧,只生成1 mol
和2 mol
,则
的分子式是。