现有五种离子化合物、、、和,都是由下表中离子形成的:
| 阳离子 |
|
| 阴离子 |
为鉴别它们,分别完成以下实验,其结果是:
a.和都不溶于水,也不容于酸;
b.溶于水后,与上述某阳离子反应可生成,且溶液与过量氨水反应生成白色沉淀;
c.溶于水后,与上述某阳离子反应可生成,且溶液与过量氨水反应生成白色沉淀。
d.溶于水后,与上述某阴离子反应可生成;
e.溶液与适量E溶液反应生成沉淀,再加入过量E溶液,沉淀量减少,但不消失。
请根据上述实验结果,填空:
(1)写出化合物的化学式:,,,。
(2)溶液与过量的溶液反应后,最终得到的化学式是。
如图所示3套实验装置,分别回答下列问题。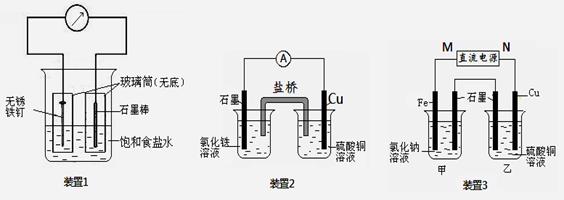
(1)装置1为铁的吸氧腐蚀实验。一段时间后, 向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。
(2)装置2中的石墨是 极(填“正”或“负” ),该装置发生的总反应的离子方程式为 。
(3)装置3中甲烧杯盛放200 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放200 mL 1.0 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红。
|
① 电源的M端为 极,甲烧杯中铁电极的电极反应为 ②停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 1.28 g,甲烧杯中产生的气体标准状况下体积为 mL 。
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+ 2H2(g) CH3OH(g)
CH3OH(g)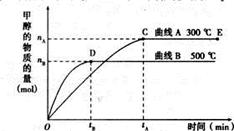
根据题意完成下列各题:
(1)5000C,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=(用nB、 tB 表示)
(2)在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的1/2,下列有关该体系的说法正确的是
a .氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(3)可逆反应:CO(g)+ 2H2(g) CH3OH(g) 在恒容密闭容器中反应,达到平衡状态的标志是:
CH3OH(g) 在恒容密闭容器中反应,达到平衡状态的标志是:
①单位时间内生成2n molH2的同时生成n mol CH3OH
②单位时间内生成2n molH2的同时,生成n mol CO
③用CO、H2、CH3OH 的物质的量浓度变化表示的反应速率的比为1 : 2 : 1的状态
④混 合气体的密度不再改变的状态
⑤ 混合气体的平均相对分子质量不再改变的状态
(4)改变下列哪些条件能增大甲醇的产量()
| A.增大容器体积 | B.增大压强 | C.升高温度 | D.加催化剂 |
(5)反应达到平衡后再升高温度,K值(填“增大”“减小”或“不变”)。
(6)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:(用化学方程式表示)。
工业上常利用反应 3Cl2+8NH3 =6NH4Cl+N2 检查氯气管道是否漏气。回答下列问题:
(1)该反应中,氧化剂是,发生氧化反应的物质是。
(2)该反应中氧化剂与还原剂的物质的量之比为。
(3)若标准状况下有6.72L N2生成,则转移电子的物质的量为mol。
亚铁盐不稳定,在空气中易被氧化,因此在存放FeSO4溶液时,常加入 ,其理由是(用离子方程式表示)。
新制的氯水,呈浅黄绿色,说明氯水中含有分子(填化学式);向新制氯水中,加入AgNO3溶液有白色沉淀产生,说明氯水中含离子(填离子符号);向新制氯水中,放入一块有色布条,一段时间后取出,发现有色布条褪色,说明氯水具有性。