在恒容密闭容器中,反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0达到平衡后,改变某一条件,下列说法正确的是
CH3OH(g)+H2O(g) △H<0达到平衡后,改变某一条件,下列说法正确的是
| A.升高温度,正反应速率减小,逆反应速率增加,平衡逆向移动 |
| B.升高温度,可提高CO2转化率 |
| C.增加H2的浓度,可提高CO2转化率 |
| D.改用高效催化剂,可增大反应的平衡常数 |
下列有关说法不正确的是
| A.所有放热反应都有自发进行的倾向,可用焓判据证明 |
| B.凡是熵减的过程都是不能自发进行的,可用熵增原理证明 |
| C.把两种彼此不发生反应的气体通入到一个密闭容器中,能自发地混合均匀 |
| D.在封闭体系中焓减或熵增的化学反应是容易自发发生的 |
关于强、弱电解质的叙述不正确的是
| A.强电解质在溶液中完全电离,不存在电离平衡 |
| B.强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱 |
| C.同一弱电解质同浓度的溶液,温度不同时,导电能力不同 |
| D.强电解质在固态或液态时,可能不导电 |
下列措施不能达到节能减排目的的是
| A.利用太阳能制氢燃料 | B.用家用汽车代替公交车 |
| C.利用潮汐能发电 | D.用节能灯代替白炽灯 |
在一定条件下,在容积为2L的密闭容器中,将2 mol 气体M和3 mol N气体混合,发生如下反应:2M(g) + 3N(g) 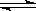 x Q(g) +3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是
x Q(g) +3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是
| A.x值为2 | B.混合气体的密度增大 |
| C.平衡时N的浓度为0.2 mol/L | D.N的转化率为80% |
下列事实不能用勒夏特列原理来解释的是
| A.加压有利于SO2与O2反应生成SO3 |
| B.温度过高对合成氨反应不利 |
| C.高温及加入催化剂都能使合成氨的反应速率加快 |
| D.用过量空气煅烧硫铁矿可以提高原料的利用率 |