(14分) Ⅰ.工业合成氨与制备硝酸一般可连续生产,回答下列问题:
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2。T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_______(填计算结果)。
CO2+H2。T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_______(填计算结果)。
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为: 。
(3)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为 。
Ⅱ。甲醇是一种重要的有机化工原料,可用于制取甲醚。一定温度下,在三个体积为1.0L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+ H2O(g)。
CH3OCH3(g)+ H2O(g)。
| 容器编号 |
温度(℃) |
起始物质的量(mol) |
平衡物质的量(mol) |
|
| CH3OH(g) |
CH3OCH3(g) |
H2O(g) |
||
| I |
387 |
0.20 |
0.080 |
0.080 |
| II |
387 |
0.40 |
a |
b |
| III |
207 |
0.20 |
0.090 |
0.090 |
(4)容器I中的反应达到平衡时所需的时间_______(填“大于”“小于”或等于)容器II中的。
(5)a= 。
(6)下列说法中能说明该反应达到平衡状态的是 。(填字母)
A.容器中压强不变
B.混合气体中c(CH3OCH3) 不变
C.混合气体的密度不变
D.单位时间内生成CH3OH与CH3OCH3的分子个数之比为2:1
(7)已知下面两个反应(m、n均大于0):
反应①:CO(g)+2H2(g)  CH3OH(g) ΔH=-m kJ·mol-1
CH3OH(g) ΔH=-m kJ·mol-1
反应②:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) ΔH= -n kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -n kJ·mol-1
则下列m与n的关系中,正确的是 (填字母)。
A.n﹥2m B.m﹥2 n C.2m﹥n D.m﹥3n
W.X.Y.Z均为短周期主族元素,W的最外层电子数与核外电子总数之比为3:8;X的核外电子总数与Y的最外层电子数相等,X的原子 序数是Z的原子序数的一半;W.Y.Z位于同一周期。
序数是Z的原子序数的一半;W.Y.Z位于同一周期。
(1)W的单质是一种色晶体。
(2)W.Y.Z三种元素的气态氢化物稳定性由高到低的顺序是(用化学式表示,Z的气态氢化物与其同主族元素气态氢化物化学式写法相似)。
(3)用化学方程式证明元素原子的得电子能力Y强于W
(4)Y的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种 稀溶液,并放出QkJ的热量,写出该反应的热化学方程式。
稀溶液,并放出QkJ的热量,写出该反应的热化学方程式。
(5)已知A.B.C.D四种物质存在如下反应关系: A+B C+D
C+D
①若A是Y和Z常见价态的化合物,B是X的氢化物,D是Y的氢化物,反应过程中没有化合价变化,该反应的化学方程式是。
②若A是Z的单质,B为红色固体,D为紫红色固体单质,高温下发生该反应,C的化学式是。D与X元素最高价氧化物对应水化物的浓溶液反应,生成的气体会对大气 造成污染。用烧碱溶液吸收该气体生成两种盐,其中一种盐可用作防腐剂,烧碱溶液吸收气体的离子方程式是。
造成污染。用烧碱溶液吸收该气体生成两种盐,其中一种盐可用作防腐剂,烧碱溶液吸收气体的离子方程式是。
(16分)化合物X是一种常用的香精。已知X的相对分子质量为100,X能水解,完全燃烧只生成CO2和H2O,且X分子中碳和氢元素总的质量百分含量约为68%。
(1)X的分子式是。
(2)G和X互为同分异构体,且具有相同的官能团,用烃A合成G的路线如下: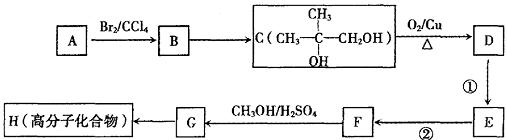
①写出A和D的结构简式:A.,D.。
②B→C反应的反应条件是。
③E→F的反应类型是反应,该反应的化学方程式为。
④G→H的化学方程式为。
(3)与D具有相同官能团的D的同分异构体还有的同 分异构体还有种。
分异构体还有种。
(14分A、B、C、 D 、E、F是常见的气体,其中A、B、C、D为单质,有关的转化关系如下图所示(反应条件均已略去)。
D 、E、F是常见的气体,其中A、B、C、D为单质,有关的转化关系如下图所示(反应条件均已略去)。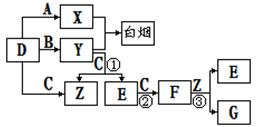
请回答下列问题:
(1)D的电子式为。
(2)反应 ③的离子方程式为。
③的离子方程式为。
(3)Y和E在一定条件下可反应生成B和Z,可消除E对环境的污染,该反应的化学方程式 为。
为。
(4)常温下0.1mol/L的Y溶液中c(H+)/c(OH-)=1×10-8,下列叙述正确的是。
①该溶液的pH=11
②该溶液中的溶质电离出的阳离子浓度为0.1mol/L
③将pH=11的Y溶液加水稀释100倍后,pH值为9
④该 溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
⑤0.1mol/L的盐酸溶液V1 L与该0.1mol/L的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
(5)常温下pH=a的X溶液和pH=b的Y溶液等体积混合,若a+b=14,则混合后的溶液呈________性,混合溶液中各离子浓度大小关系为____________________。
(14分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300-1700oC的氮气流中反应制得3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)上述反应氧化剂是,已知该反应每转移1mole—,放出132.6kJ的热量,该方程式的∆H =。
(2)能判断该反应(在体积不变的密闭容器中进行)已经达到平衡状态的是。
| A.焦炭的质量不再变化 | B.N2和CO速率之比为1:3 |
| C.生成6molCO同时消耗1mol Si3N4 | D.混合气体的 密度不再变化 密度不再变化 |
(3)该反应的温度控制在1300-1700oC的原因是。
(4)某温度下,测得该反应中N2和CO各个时刻的浓度如下,则0—20 min内N2的平均
反应速率,在平衡混合气体中CO的体积分数是。
| 时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
| N2浓度 /mol·L-1 |
4.00 |
3.70 |
3.50 |
3.36 |
3.26 |
3.18 |
3.10 |
3.00 |
3.00 |
3.00 |
| CO浓度 /mol·L-1 |
0.00 |
0.90 |
1.50 |
1.92 |
2.22 |
2.46 |
2.70 |
— |
— |
— |
已知X是一种具有果香味的合成香料,下图为合成X的某种流程。 E是生活中常见的一种有机物,碳、氢的质量分数分别为52.17% 、13.04% ,其余为氧,质谱分析得知其相对分子质量为46,核磁共振氢谱显示其有三种氢原子,且个数比为1:2:3。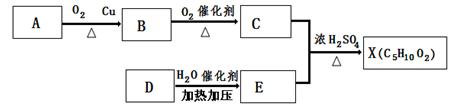
请根据以上信息,回答下列问题:
(1)A分子中官能团的名称是:,E的结构简式是:
(2)D→E的化学反应类型为:反应。
(3)上述A、B、C、D、E、X六种物质中,互为同系物的是:
(4)C的一种同分异构体F可以发生水解反应和银镜反应,则F的结构简式和名称为。
(5)反应C + E→X的化学方程式为。
(6)验证B分子中官能团试剂的配制和官能团鉴别操作是。