下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是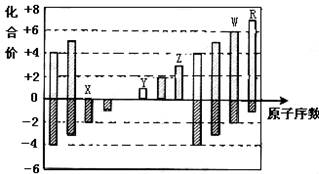
| A.WX3和水反应形成的化合物是弱电解质 |
| B.气态氢化物的还原性:R>W |
| C.离子半径:Z>Y>X |
| D.Y、Z、R三种元素分别形成的最高价氧化物对应的水化物两两间能发生反应 |
类推的思维方式在化学学习研究中有时会产生错误的结论,因此类推的结论最终要经过实践的检验才能决定其正确与否,以下几个类推的结论中不正确的是
①由H2O在液态时分子间存在氢键,类推出C2H5OH在液态时分子间也存在氢键
②SO2能与碱反应,推测:非金属氧化物都能与碱反应
③金属钠着火不能用CO2扑灭,推测:金属钾着火也不能用CO2扑灭
④由不能用电解熔融状态AlCl3来制取铝,类推出也不能用电解熔融状态MgCl2溶液制取镁
| A.①② | B.②④ | C.②③④ | D.①②③④ |
已知短周期元素的离子:aAm+、bBn+、cCm-、dDn-(m>n)都具有相同的电子层结构,则下列叙述正确的是
| A.原子半径:A>B>C>D | B.原子序数:d>c>b>a |
| C.离子半径:C>D>B>A | D.单质的还原性:A>B>D>C |
北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子晶体,具有良好的超导性。下列有关分析正确的是
| A.K3C60中只有离子键 | B.K3C60中碳元素显-3价 |
| C.该晶体在熔融状态下能导电 | D.C60与12C互为同素异形体 |
一定条件下,氨气与氟气发生反应:4NH3+3F2  NF3+3NH4F,其中NF3分子构型与NH3相似。下列有关说法错误的是
NF3+3NH4F,其中NF3分子构型与NH3相似。下列有关说法错误的是
A.NF3 的分子构型是三角锥型 的分子构型是三角锥型 |
B.NF3既是氧化产物,又是还原产物 |
C.NH4F 中既含有离子键又含有共价键 中既含有离子键又含有共价键 |
D.上述反应中,反应物和生成物均属于分子晶体 |
在相同条件下,分别将下列气体等体积混合于四支大小相同的试管中:①NO与NO2;②NO与O2;③NO2与O2;④SO2与NO2,将四支试管倒立于水中,各试管中水面上升高 度应为
度应为
| A.①>②>③>④ | B.②>③>④> ① ① |
C.①=②=③=④ | D.③>②>①>④ |