同学们用高锰酸钾制氧气.制取结束清洗仪器.发现加热高锰酸钾的试管内壁有用水洗刷不掉的黑色固体.
问题一:黑色固体是什么?
【交流讨论】同学们结合实验现象和对高锰酸钾及其分解产物的了解.进行分析判断.
| 判断 |
依据 |
| 不是
|
能溶于水形成紫红色溶液 |
| 不是 |
冲洗试管时出现深绿色溶液,说明该物质能溶于水 |
| 是
|
其他实验用过
,知道它是不溶于水的黑色固体 |
【实验验证】向未洗净的试管中加入某种液体,产生能使带火星木条复燃的气体.证明上述判断正确.加入的液体是
问题二:用什么洗掉
?
【交流讨论】
与
、
、
、
、
中的某一种物质组成最相近,理由是
【实验验证】向未洗净的试管中加入稀盐酸,黑色固体没有变化.
【交流讨论】实验说明同一类物质的化学性质不一定相同.
有什么化学性质,用什么试剂清洗呢?同学们请教老师后决定用草酸(
)溶液试一试.
【实验验证】向未洗净的试管中加入草酸溶液,黑色固体果然被除去,同时发现产生许多气泡.
问题三:生产了什么气体?
【交流讨论】化学变化过程中元素不变,因为
【实验验证】经检验,产生的气体是
,检验
气体的操作和现象是:
【反思提高】以上探究活动中,清除试管内壁附着的难溶物的思路是:先
某食品包装袋内有一个小纸袋,上面写着“干燥剂,主要成分是生石灰”。
(1)生石灰可作干燥剂的理由是(用化学方程式表示):。
(2)某同学对此干燥剂作了一系列探究,其实验方案如下,请你完成下列实验报告。
| 问题与猜想 |
实验步骤 |
实验现象 |
实验结论 |
| 问题1:小纸袋中的物质能否继续作干燥剂? |
取适量小纸袋中固体放入烧杯中,加入适量水,触摸杯壁。 |
不能作干燥剂 |
|
| 问题2:猜想变质后的物质可能是什么? 。 |
变质后固体中有 |
一瓶无色液体A,含有NaCl、NaOH和Na2CO3中的两种;一包白色粉末B,含有CaO、Ca(OH)2和CaCO3中的两种。化学小组的同学为了探究A和B的成分,设计了如下图所示的实验方案,请根据图示过程回答问题。
(1)固体C难溶于水,是一种常见的补钙产品,则固体C是,与盐酸反应的化学方程式为。
(2)液体A中一定含有的一种溶质为,白色粉末B中一定含有的一种物质为。试写出滤液1与液体A之间发生反应的化学方程式为。
(3)小组同学们分析发现:假设溶液A滴加适量,若滤液2中只含有一种溶质,则原无色溶液A中含有的另外一种溶质是;若滤液2中含有两种溶质,则原无色溶液A中含有的另外一种溶质是。
传统腌制松花蛋的主要配料是氧化钙、纯碱和食盐.某活动小组将这三种物质混合后加入适量水搅拌、过滤后,对滤液中溶质的成分进行探究:
【猜想与假设】
甲同学猜想:可能是
、
、
乙同学猜想:可能是
、
、
丙同学猜想:可能是
丁同学猜想:可能是
、
【交流与评价】大家一致认为甲同学的猜想不成立,理由是.
【活动与探究】
| 实验步骤 |
实验现象及相关的化学方程式 |
实验结论 |
| 乙同学取一定量的滤液于试管中,向其中加入一定量的盐酸 |
有大量气泡产生,写出所有可能发生的化学反应方程式 | 乙同学的猜想成立 |
| 丙同学 | 实验现象 | 丙同学的猜想不成立 |
| 丁同学取一定量的滤液于试管中,向其中滴加少量盐酸 |
无气泡产生 |
乙同学的猜想不成立 |
【解释与结论】丁同学的结论是否正确(填"正确"或"不正确").丁同学和乙同学使用了相同的试剂,却没有看到气泡产生,你认为可能的原因是.
通过一年的学习,小明知道了氧气的实验室制法有多种途径.结合下列装置图,按要求回答问题.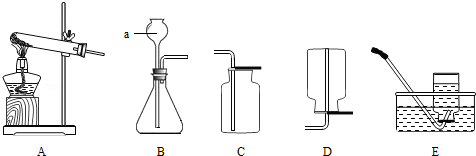
(1)请你在
处写出另一种实验室制取氧气的方法.
A.加热高锰酸钾 B.分解过氧化氢溶液 C.
(2)写出标号仪器的名称:
.若用加热高锰酸钾制取氧气,写出反应的化学方程式,应选用的气体发生装置(填写字母序号,下同).
(3)小明了解到,向鱼池中撒入过氧化钙固体可增加鱼池中的含氧量.
【提出问题】实验室能否用过氧化钙固体与水反应制取氧气?
【查阅资料】
↑
| 实验装置的选择 |
实验主要过程及现象 |
|
气体发生装置应选 收集较纯净的氧气应选 |
检查装置的气密性,将水加入过氧化钙中,开始有较多细小气泡放出,随后放出气泡的速度减缓,只收集到极少量气体.该装置放置到第二天,集气瓶中只收集到少量气体,振荡后又有少量细小气泡缓慢放出 |
【实验结论】.
【分析与反思】过氧化钙与水反应"开始有较多细小气泡放出,随后放出气泡的速度减缓"的原因可能是.
同学们都知道
溶液呈蓝色,那么,你们知道是溶液中什么微粒使
溶液呈蓝色吗?
基于初中所学知识,下面主要采用不同的思维方式对该问题进行探讨.
(说明:以下溶液皆为稀溶液,在稀溶液中
呈无色.)
思路一:采用归纳法,由具体事实推理概括出一般原理或结论.
下图一:请比较
五支试管中所盛试剂的颜色与所含微粒,进行分析.
对
的分析是: ,说明
的存在使
溶液显蓝色.
对 分析,可以说明,在水溶液中,
是无色的.
对
的分析是: ,说明
中是
使
溶液显蓝色.对
分析同理.
对
还可推理:水是无色液体,作为溶剂,溶解
等物质时,溶液的颜色主要受溶质的影响.
思路二:采用加入试剂发生化学反应的方法将溶液中的
除去或保持溶液中
的存在,观察溶液颜色是否变化的方法.
例1:如图二所示的方法是除去溶液中的
.该反应的化学方程式为: .
例2:请选择一种试剂与
溶液反应,保持溶液中
的存在.其化学方程式是: .
上述研究方法是用不同的思维方式,从不同的切入点研究同一个问题,但总体思路仍然是对比实验设计的一般思路.