欲在实验室配置100 g 16%的氯化钠溶液进行选种,下列做法正确的是
| A.计算:需要16 g氯化钠,100 g水 |
| B.称量:用托盘天平称量所需的氯化钠 |
| C.量取:用50 mL量筒量取所需的水 |
| D.溶解:将称得的氯化钠倒入量筒溶解 |
去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示。下列说法正确的是
| A.每个去甲肾上腺素分子中含有3个酚羟基 |
| B.每个去甲肾上腺素分子中含有8种氢原子 |
| C.1mol去甲肾上腺素最多能与2molBr2发生取代反应 |
| D.去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应 |
热化学方程式C(s)+H2O(g)= CO(g)+H2(g) △H =+131.3kJ/mol表示
| A.碳和水反应吸收131.3kJ能量 |
| B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量 |
| C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ |
| D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ |
下列说法不正确的是
| A.原子半径Na﹤Mg﹤Al | B.热稳定性:HCl﹥H2S﹥PH3 |
| C.碱性:KOH﹥NaOH﹥Mg(OH)2 | D.酸性强弱:H2SiO3﹤H2CO3﹤H3PO4 |
下列有关实验装置进行的相应实验,能达到实验目的的是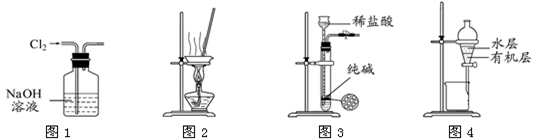
| A.用图1所示装置除去Cl2中含有的少量HCl |
| B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| C.用图3所示装置制取少量纯净的CO2气体 |
| D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
下列化学用语表述正确的是
A.Na的原子结构示意图: |
| B.N2分子的结构式:N=N |
C.HC1的电子式: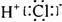 |
D.H2O分子的球棍模型: |