已知短周期元素的离子aA3+,bB+,cC2-,dD-都具有相同的电子层结构,则下列叙述中正确的是
| A.原子半径:A>B>D>C | B.原子序数:d>c>b>a |
| C.离子半径:C>D>B>A | D.单质的还原性:A>B>D>C |
下列情况下,离子组间一定能在溶液中同时大量共存的是( )
| A.pH=2的溶液中:SO42-、K+、NO3-、Mg2+ |
| B.pH试纸呈现红色的溶液:Fe2+、K+、NO3-、Na+ |
| C.水电离出的c(H+)=10-14mol/L的溶液中:Na+、HCO3-、Cl-、SO42- |
| D.CO32-可以大量存在的溶液:Ag+、K+、NO3-、Al3+ |
原子结构决定元素的性质,下列说法中,正确的是( )
| A.Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小 |
| B.在第ⅥA族元素的氢化物(H2R)中,热稳定性最强的其沸点也一定最高 |
| C.第2周期元素的最高正化合价都等于其原子的最外层电子数 |
| D.非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强 |
下列说法不正确的是( )
| A.利用太阳能在催化剂参与下分解水制氢是把光能转化为化学能的绿色化学 |
| B.蔗糖、淀粉、油脂及其水解产物均为非电解质 |
| C.通过红外光谱分析可以区分乙醇和乙酸乙酯 |
| D.石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃. |
某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:aA(g)+B(g) C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则()
C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则()
| A.a=3 | B.a=2 | C.B的转化率为40% | D.B的转化率为60% |
在容积不变的密闭容器中进行反应:2SO2(g)+O2(g)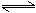 2SO3(g)△H<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中正确的是()
2SO3(g)△H<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中正确的是()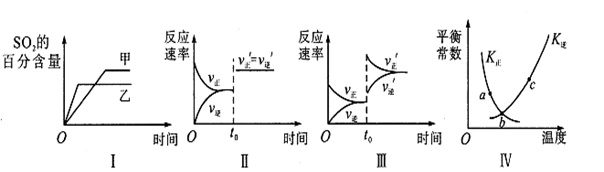
| A.图I表示温度对化学平衡的影响,且甲的温度较高 |
| B.图Ⅱ表示t0时刻使用催化剂对反应速率的影响 |
| C.图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响 |
| D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态 |