二氧化硫和氮氧化物都是常见的大气污染物,回答下列相关问题。
Ⅰ某温度下氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
i.2NO(g)+Cl2(g) 2ClNO(g) △H1<0 其平衡常数为K1
2ClNO(g) △H1<0 其平衡常数为K1
ii.2NO2(g)+NaCl(s)  NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2
NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2
(1)现有反应4NO2(g)+2NaCl(s)  2NaNO3(s)+2NO(g)+Cl2(g),则此反应的平衡常数K3= (用K1、K2表示),反应热△H3= (用△H1、△H2表示)。
2NaNO3(s)+2NO(g)+Cl2(g),则此反应的平衡常数K3= (用K1、K2表示),反应热△H3= (用△H1、△H2表示)。
(2)为研究不同条件对反应ii的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO2和足够的NaCl(s),10min时反应ii达到平衡。测得平衡时NO2的转化率α1(NO2) =50%,则:
①10min内υ(ClNO) = ,平衡常数K2= ;
②若其它条件不变,使反应在恒压条件下进行,平衡时NO2转化率为α2(NO2),则:
α1(NO2) = α2(NO2)(填“>”“<”或“=”)。
II除氮氧化物外,SO2也是重要的大气污染物,需要对其进行吸收处理。
(3)若用一定量的NaOH溶液吸收SO2气体后所得吸收液恰好呈中性,下列有关吸收液中粒子关系正确的是 。
| A.c(Na+) = c(HSO3-)+ 2c(SO32-) |
| B.c(Na+) > c(HSO3-) =c(SO32-) > c(H+) = c(OH—) |
| C.2c(Na+) =2c(H2SO3)+2c(HSO3-)+2c(SO32-) |
| D.c(Na+) > c(HSO3—) + c(SO32—) +c(H2SO3) |
(4)工业上也可以用Na2SO3溶液吸收SO2,并用电解法处理吸收后所得溶液以实现吸收液的回收再利用,装置如图所示,则
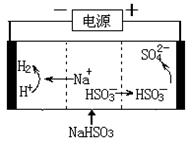
①工作一段时间后,阴极区溶液的pH (填“增大”“减小”或“不变”);
②写出阳极的电极反应式 。
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设
假设1:红色粉末是Fe2O3;
假设2:红色粉末是Cu2O;
假设3:。
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是。
(2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法是否合理,简述你的理由:
。
(3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是,写出发生反应的离子方程式。
过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等。过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量。
(1)某研究小组拟用下图装置测定一定质量的样品中过氧化镁的含量。
①实验前需进行的操作是 ,稀盐酸中加入少量FeCl3溶液的作用是 。
②用恒压分液漏斗的优点有:使分液漏斗中的溶液顺利滴下;。
③实验终了时,待恢复至室温,先 ,再平视刻度线读数。
(2)实验室还可通过下列两种方案测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入 NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。
已知常温下Ksp[Mg(OH)2]=l×10-11。为使方案I中Mg2+完全沉淀[即溶液中c(Mg2+)≤l ×10-5mol/L],溶液的pH至少应调至。
方案Ⅱ:用电子天平称取0.1000g样品置于锥形瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,加入少量 作指示剂;然后用 式滴定管盛装0. 1000 mol/L Na2S2O3溶液进行滴定. (已知:I2+2Na2S2O3= Na2S4O6+2NaI)
肉桂酸是一种香料,具有很好的保香作用,通常作为配香原料,可使主香料的香气更加清香。实验室制备肉桂酸的化学方程式为: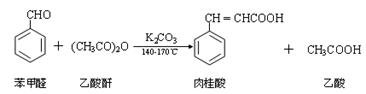
主要试剂及其物理性质
| 名称 |
分子量 |
性状 |
密度g/cm3 |
熔点℃ |
沸点℃ |
溶解度:克/100ml溶剂 |
||
| 水 |
醇 |
醚 |
||||||
| 苯甲醛 |
106 |
无色液体 |
1.06 |
-26 |
178-179 |
0.3 |
互溶 |
互溶 |
| 乙酸酐 |
102 |
无色液体 |
1.082 |
-73 |
138-140 |
12 |
溶 |
不溶 |
| 肉桂酸 |
148 |
无色结晶 |
1.248 |
133-134 |
300 |
0.04 |
24 |
溶 |
密度:常压,25℃测定主要实验步骤和装置如下:
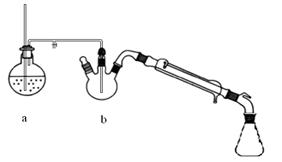
图1制备肉桂酸的反应装置图图2水蒸气蒸馏装置图
Ⅰ合成:按图1连接仪器,加入5mL苯甲醛、14mL乙酸酐和7.02g无水碳酸钾。在140~170℃,将此混合物回流45min。
Ⅱ分离与提纯:
①将上述合成的产品冷却后边搅拌边加入40ml水浸泡5分钟,并用水蒸气蒸馏,从混合物中除去未反应的苯甲醛,得到粗产品
②将上述粗产品冷却后加入40ml 10%的氢氧化钠水溶液,再加90ml水,加热活性炭脱色,趁热过滤、冷却;
③将1:1的盐酸在搅拌下加入到肉桂酸盐溶液中,至溶液呈酸性,经冷却、减压过滤、洗涤、干燥等操作得到较纯净的肉桂酸;
水蒸气蒸馏:使有机物可在较低的温度下从混合物中蒸馏出来,可以避免在常压下蒸馏时所造成的损失,提高分离提纯的效率。同时在操作和装置方面也较减压蒸馏简便一些,所以水蒸气蒸馏可以应用于分离和提纯有机物。回答下列问题:
(1)合成肉桂酸的实验需在无水条件下进行,实验前仪器必须干燥。实验中为控制温度在140~170℃需在中加热(请从下列选项中选择)。
A.水 B.甘油(沸点290℃) C. 砂子 D.植物油(沸点230~325℃)
反应刚开始时,会有乙酸酐(有毒)挥发,所以该实验应在中进行操作。
(2)图2中水蒸气蒸馏后产品在(填仪器名称)
(3)趁热过滤的目的,方法:。
(4)加入1:1的盐酸的目的是,析出的肉桂酸晶体通过减压过滤与母液分离。下列说法正确的是。
A.选择减压过滤是因为过滤速度快而且能得到较干燥的晶体
B.放入比布氏漏斗内径小的滤纸后,直接用倾析法转移溶液和沉淀,再迅速开大水龙头抽滤
C.洗涤产物时,先关小水龙头,用冷水缓慢淋洗
D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,再关水龙头
(5)5mL苯甲醛、14mL乙酸酐和7.02g无水碳酸钾充分反应得到肉桂酸实际3.1g,则产率是(保留3位有效数字)。
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下: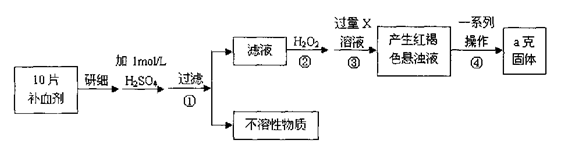 请回答下列问题:
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加,该过程的现象为:。
(2)步骤②加入过量H2O2的目的:。
(3)步骤③中反应的离子方程式:。
(4)步骤④中一系列处理的操作步骤:过滤、、灼烧、、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4—+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需。
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③滴定到终点时的颜色为色。
(7)正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂。来补充铁,则正常人每天服需用含mgFeSO4·7H2O为片剂。
中国石油天然气勘探开发公司位于尼日尔的分支机构CNPC—尼日尔石油公司,日前在该国东部最新发现了2900万桶的石油储量,勘探小组在石油样品中发现一种烃的含氧衍生物。可用下图所示装置确定其分子式和其组成。(不考虑空气进入装置)
回答下列问题:
(1)A中发生反应的化学方程式为。
(2)B装置的作用是,燃烧管C中CuO的作用是。
(3)产生氧气按从左向右流向,燃烧管C与装置D、E连接。现甲、乙两位同学提出了两种连接方案。
方案1 甲同学认为连接顺序是:C→E→D
方案2 乙同学认为连接顺序是:C→D→E
请你评价两种连接方案,判断哪种方案正确并说明理由。
,。
(4)准确称取1.8g烃的含氧衍生物X的样品,经充分燃烧后,D管质量增加2.64g,E管质量增加1.08g,实验测得X的蒸气密度是同温同压下氢气密度的45倍,则X的分子式为,1molX分别与足量Na、NaHCO3反应放出的气体在相同条件下的体积比为1∶1,X可能的结构简式为。