研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 ______ 。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如下表。
| |
Ka1 |
Ka2 |
| H2SO3 |
1.3×10-2 |
6.3×10-4 |
| H2CO3 |
4.2×10-7 |
5.6×10-11 |
①HSO3-的电离平衡常数表达式K= 。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
药物普仑司特对预防和治疗中耳炎、银屑病等均有良好疗效。在普仑司特的合成中需要用到关键中间体M(1﹣溴﹣4﹣苯丁烷)。中间体M的合成路线如下:
已知:
回答下列问题:
(1)D中的官能团为 :反应④属于 反应(填反应类型);
B的结构简式为 。
(2)写出一种满足下列条件的A的同分异构体的结构简式: 。
A.能发生银镜反应和水解反应: B.不存在顺反异构体
(3)利用溴代烃E (含溴质量分数为66.1%)为起始原料也可制得中间体M:
则E的结构简式为
F→M的化学方程式为 。
(4)C6H5MgBr与化合物G在一定条件下直接反应可制得M。①用系统命名法给化合物G命名: ;②写出加热条件下G在足量NaOH醇溶液中反应的化学方程式: 。
合成肉桂酸异戊酯G( )的路线如下:
)的路线如下:
友情提示:
①B和C含有相同的官能团且C在标准状况下的气体密度为1.964g/L;
② 。
。
回答下列问题:
(1)A的结构简式为 ,D中含有的官能团的名称是 ;
(2)下列物质在一定条件下能与F反应的是 (填标号);
A.溴水 B.酸性KMnO4溶液 C.乙酸 D.新制氢氧化铜的悬浊液
(3)B和C反应生成D的化学方程式为 。
(4)E和F反应生成G的化学方程式为 ,反应类型为 。(各2分)
(5)A的同分异构体中含有苯环的共有 种(不考虑立体异构且包括A),其中与氯化铁不能发生显色反应且核磁共振氢谱有四组峰,峰面积之比为3:2:2:1的为______ (写结构简式)。(各2分)
有增长碳链是有机合成中非常重要的反应。例如:
反应①
用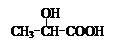 通过以下路线可合成(Ⅱ):
通过以下路线可合成(Ⅱ):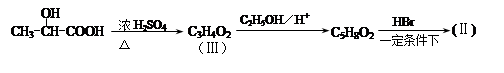
(1)(Ⅰ)的分子式为 ;1mol该物质完全燃烧需要消耗 mol O2.。
(2)(Ⅱ)与足量的热NaOH溶液反应的化学方程式为 。
(Ⅲ)的结构简式为 ;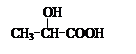 在生成(Ⅲ)时,还能得到另一种副产物C6H8O4,该反应的化学方程式为 ,该反应的反应类型是 。
在生成(Ⅲ)时,还能得到另一种副产物C6H8O4,该反应的化学方程式为 ,该反应的反应类型是 。
(4)对二氯苯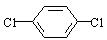 也能与有机物(Ⅰ) (过量)发生类似反应①的系列反应,其生成有机物的结构简式为 。
也能与有机物(Ⅰ) (过量)发生类似反应①的系列反应,其生成有机物的结构简式为 。
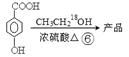
课题组以甲苯为主要原料,采用以下路线合成化妆品防霉剂:对—羟基苯甲酸乙酯。
请回答:
(1)有机物C7H7Br的名称为 。
(2)产品的摩尔质量为 。
(3)在①~⑥的反应中属于取代反应的有 。
(4) 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) 。
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) 。
(5) 的同分异构体很多,其中符合下列条件有 种。
的同分异构体很多,其中符合下列条件有 种。
①遇到FeCl3溶液出现显色现象;②能发生水解反应;③能发生银境反应;④无-CH3结构。上述同分异构体中核磁共振氢谱显示其有5种峰的结构简式为 。
(6)高分子化合物 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)。注:合成路线的书写格式参照如下示例流程图:
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)。注:合成路线的书写格式参照如下示例流程图: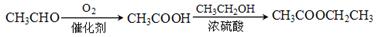
。
有机物A〜M有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与 NaHCO3溶液反应,F的分子式为C9H10O2,且不能使溴的CCl4溶液褪色;D能发生银镜反应;M与NaOH溶液反应后的产物,其一氯代物只有一种。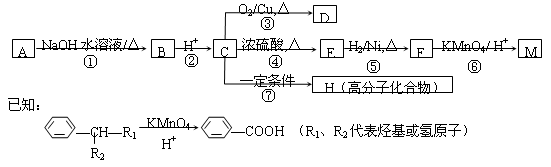
请回答:
(1)B、F的结构简式分别为 、 。
(2)反应①〜⑦中,属于消去反应的是 (填反应序号)。
(3)D发生银镜反应的化学方程式为 ;反应⑦的化学方程式为 。
(4)A的相对分子质量在180~260之间,从以上转化中不能确认A中的某一官能团,确定该官能团的实验步骤和现象为 。
(5)符合下列条件F的同分异构体共有 种。
a.能发生银镜反应
b.能与FeCl3溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6