某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水利用下图所示的实验装置进行实验。

(1)制取实验结束后,取出B中试管冷却结晶、过滤、洗涤。该实验操作过程需要的玻璃仪器有______。
(2)若对调B和C装置的位置,_____(填“能”或 “不能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的探究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3 。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):

①系列a实验的实验目的是_______。
②设计1号试管实验的作用是___________。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为_________________。
实验三 测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为:使用右图装置,加热15.0ml饱和氯水试样,测定产生气体的体积。此方案不可行的主要原因是_______(不考虑实验装置及操作失误导致不可行的原因)。

(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):______
资料:i.次氯酸会破坏酸碱指示剂;
ii.次氯酸或氯水可被SO2、H2O2、FeCl2等物质还原成Cl-。
某固体混合物可能含有 、
、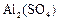 、
、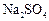 、
、 、
、 和
和 。将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”) :.
。将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”) :.
(1)将少许混合物放入水中得到无色溶液和白色沉淀。
| 肯定存在的物质 |
肯定不存在的物质 |
理由 |
(2)取溶液进行焰色反应,火焰呈黄色。
| 肯定存在的物质 |
肯定不存在的物质 |
理由 |
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
| 肯定存在的物质 |
肯定不存在的物质 |
理由 |
(4)通过上述实验仍无法确定的物质是。
下图是实验室制取Cl2并以Cl2为原料进行特定反应的实验: 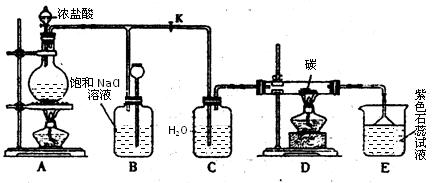
(1)A为氯气发生装置,写出反应的化学方程式________________________。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl,写出D装置中反应的化学方程式 _____;装置C的作用是 。
(3)E处石蕊试液的现象是_______________;其原因是__________________。
(4)若将E处溶液改为石灰水,反应过程的现象是_____________________________。
A.有白色沉淀生成
B.无白色沉淀生成
C.先生成白色沉淀,然后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此处B中的现象是________________,B的作用是________________。
[化学选修──有机化学基础]
根据图示回答下列问题:
(1)写出A、E、G的结构简式:A_____________,E_______________,G______________;
(2)反应②的化学方程式(包括反应条件)是_________________________,
(3)反应④化学方程式(包括反应条件)是______________________ ______________;
(4)写出①、⑤的反应类型:①________________、⑤__________________。
为研究铁质材料与热浓硫酸的反应,某小组进行了以下探究活动:
[探究一]
(1)称取铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中是否含有Fe2+,应选择加入的试剂为____(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
②乙同学取672 mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g。据此推知气体Y中SO2的体积分数为____。(相对原子质量:O—16 S—32 Ba—137)
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
(2)写出产生CO2的化学方程式____。
(3)装置A中试剂的作用是____。
(4)简述确认气体Y中含有CO2的实验现象。
(5)如果气体Y中含有H2,预计实验现象应是。
下图中A~J均代表无机物或其水溶液,其中A是一种红棕色粉末,B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料。
根据图示回答问题:
(1)写出下列物质的化学式:A ,E,I;
(2)反应①的化学方程式是;
反应②的化学方程式是;
(3)J与盐酸反应的离子方程式是;
反应后的溶液与D反应的化学方程式是。