已知X+、Y2+、Z―、W2―四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,不正确的是
| A.原子半径:X>Y>Z>W | B.原子序数:Y>X>Z>W |
| C.原子最外层电子数:Z>W>Y>X | D.还原性:X>Y,W2―>Z― |
下列化学用语的表达正确的是:
| A.NaHSO3在溶液中的电离:NaHSO3=Na++H++SO32- |
B.Cl-的结构示意图 |
| C.HClO结构式:H-Cl-O |
| D.医用钡餐的化学式:BaSO4 |
下表是几种电解质的电离常数(25℃) 电解质的强弱判断正确的是
电解质的强弱判断正确的是
| A.e最弱 |
| B.b最强 |
| C.由强到弱的顺序为a> b> d >e >c |
| D.无法确定 |
反应N2O4(g) 2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。正确的是
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。正确的是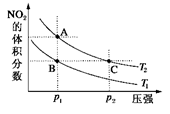
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C. A、C两点气体的平均相对分子质量:A>C
D.由状态B到状态A,可以用加热的方法
在一定温度下,向密闭容器中充入1.0molN2和3.0molH2,反应达到平衡时测得NH3的物质的量为0.6mol.若在该容器中开始时充入2.0molN2和6.0molH2,则平衡时NH3的物质的量为
| A.若为定容容器,n(NH3)="1.2mol" |
| B.若为定容容器,n(NH3)>1.2mol |
| C.若为定压容器,n(NH3)>1.2mol |
| D.若为定压容器,n(NH3)<1.2mol |
某温度下,H2(g)+CO2(g)  H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=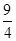 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示。下列判断不正确的是
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示。下列判断不正确的是
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2)(mol·L-1) |
0.010 |
0.020 |
0.020 |
| c(CO2)(mol·L-1) |
0.010 |
0.010 |
0.020 |
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D.反应开始时,丙的反应速率最快,甲的反应速率最慢