实验室制备1,2—二溴乙烷的反应原理如下:CH3CH2OH  CH2=CH2,CH2=CH2+Br2
CH2=CH2,CH2=CH2+Br2 BrCH2CH2Br。用少量的溴和足量的乙醇制备l,2—二溴乙烷的装置如下图所示:
BrCH2CH2Br。用少量的溴和足量的乙醇制备l,2—二溴乙烷的装置如下图所示:
有关数据列表如下:
| |
乙醇 |
1,2—二溴乙烷 |
乙醚 |
| 状态 |
无色液体 |
无色液体 |
无色液体 |
| 密度/g·cm-3 |
0.79 |
2.2 |
0.71 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
| 熔点/℃ |
-130 |
9 |
-116 |
回答下列问题:
(1)在装置c中应加入 (选填序号),其目的是吸收反应中可能生成的酸性气体。
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)判断d管中制备二溴乙烷反应已结束的最简单方法是 。
(3)将二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的 (填“上”或“下”)层。
(4)若产物中有少量未反应的Br2,最好用 (填正确选项前的序号)洗涤除去。
①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(5)反应过程中需用冷水冷却(装置e),其主要目的是 ;但不用冰水进行过度冷却,原因是: 。
(6)以1,2—二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2—二溴乙烷通过( ① )反应制得( ② ),②通过( ③ )反应制得氯乙烯,由氯乙烯制得聚氯乙烯。
①______________(填反应类型)
②________________(填该物质的电子式)
③______________(填反应类型)
写出第一步的化学方程式_________________。
长期存放的亚硫酸钠可能会被氧化,某化学课外活动小组现通过实验来确定某无水亚硫酸钠变质,并测定亚硫酸钠的纯度。
Ⅰ.有三位学生各取少量样品设计了下述三个实验方案,并都认为如果观察到的现象和自己设计的方案一致,即可确证试液中有SO42-离子。你认为合理的方案有。
方案甲:试液 白色沉淀
白色沉淀 白色沉淀。
白色沉淀。
方案乙:试液 有无色气体生成
有无色气体生成 白色沉淀。
白色沉淀。
方案丙:试液 无色溶液
无色溶液 白色沉淀。
白色沉淀。
Ⅱ.同学丁取35g该样品,加入800mL某浓度的盐酸,加热使生成的气体全部逸出,所得气体用氨水吸收,溶液增重16g。然后向原溶液中逐滴加入0.5mol/L的Ba(OH)2溶液500mL。有沉淀生成,此时溶液呈中性。
(1)用氨水吸收气体发生反应的可能的离子方程式
。
(2)样品中Na2SO3的纯度是,盐酸的物质的量浓度________________。
某同学欲用右图装置制备乙酸乙酯,其中a试管中是浓硫酸、乙醇、乙酸的混合液, b试管盛饱和Na2CO3溶液。回答下列问题: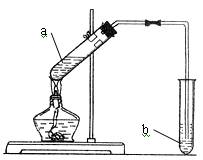
(1)指出装置中一个明显的错误
(2)配制浓硫酸、乙醇、乙酸的混合液的正确操作顺序是。
(3)写出试管a中所发生反应的化学方程式,其反应类型为。
(4)反应结束后振荡b试管的混合液,可观察到b试管中有细小气泡冒出,写出表示该反应的离子方程式。
(5)从b试管中分离出乙酸乙酯的分离方法是。
(6)浓硫酸在此反应中的作用是。
某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题
⑴第1步:灼烧。操作是将足量海带放到灼烧成灰烬。
A.试管 B.瓷坩埚
⑵第2步:Iˉ溶液的获取。操作是将灰烬转到烧杯中,加适量蒸馏水,用充分搅拌,煮沸,。(填操作名称)
⑶第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用。(填代号)A.新制氯水 B.H2O2 C.KMnO4溶液
理由是。
⑷第4步:碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。
实验室里可用甲醇等有关物质制备HCHO,关于甲醇和甲醛的沸点和水溶性见下表:
| 沸点(℃) |
水溶性 |
|
| 甲醇 |
65 ℃ |
与水混溶 |
| 甲醛 |
-21 ℃ |
与水混溶 |
某校化学兴趣小组的甲、乙两位同学,在研究性学习中,运用以上信息和已有知识分别设计了二套实验室制取HCHO装置,如图甲和乙。据此请你回答下列问题:
(1)若按甲装置进行实验,则通入A试管的X应是________;B中反应的化学方程式是__________________________________________________。
(2)若按乙装置进行实验,则B管中应装入________。
(3)当实验完成时,若在C中滴加适量银氨溶液,并用水浴将C加热,发生反应的化学方程式是_________________________________________________________。
(4)在反应过程中,甲、乙两种装置中都需直接加热的仪器是________(填A、B、C)
(5)实验开始时,先打开气球D的开关,直至实验结束。气球D的作用是______________________________________________________________________。
(6)从生成甲醛的产量来看,你认为两套装置中较好的是________(填“甲”或“乙”)
糖尿病是“富贵病”,请你设计实验检验病人尿液中的葡萄糖,并与正常人作对比,设计要求:(1)写出实验所用化学药品。
(2)写出实验现象并作出结论。