某学生在做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关的实验现象。现在请你帮助该学生整理并完成实验报告。
(1)实验目的:_______________________。
(2)实验用品:
仪器:试管、胶头滴管。
药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳。
(3)实验内容(在下表横线中填写相关内容):
| 序号 |
实验方案 |
实验现象 |
| ① |
向盛有少量溴化钠溶液的试管中滴加少量新制的氯水,振荡,再注入少量四氯化碳,振荡后静置 |
液体分为两层,下层呈________色 |
| ② |
向盛有少量碘化钾溶液的试管中滴加少量溴水,振荡,再注入少量四氯化碳,振荡后静置 |
液体分为两层,下层呈________色 |
(4)实验结论:___________________________。
(5)问题和讨论:
①上述两个实验中发生反应的离子方程式分别为__________________、__________________。
②由于F2过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举两项事实说明氟的非金属性比氯强____________________、____________________________
(14分)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行: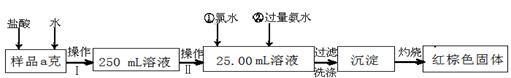
请根据上面流程,回答以下问题:
(1)操作I 所用到的玻璃仪器除烧杯、玻璃棒、量筒外,还必须有(填自选仪器名称),操作II 必须用到的仪器是(从以下选项中选择,填编号)。
| A.50mL烧杯 | B.50mL量筒 | C.25mL碱式滴定管 | D.25mL酸式滴定管 |
(2)加入试剂①和②后发生反应的离子反应方程式为:
(3)将沉淀物加热,并置于干燥器中冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2="0.3" g,则接下来还应进行的操作是____________。
(4) 若坩埚质量是W1g,坩埚与加热后固体总质量是W2g,则样品中铁元素的质量分数是:。
(5) 有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的。他的理由是:
(用化学方程式表示)
学习小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
Ⅰ.摩擦剂中氢氧化铝的定性检验:取适量牙膏样品,加水搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是____
____________________________________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是_____
_____________________________________________________________________。
Ⅱ.牙膏样品中碳酸钙的定量测定:利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。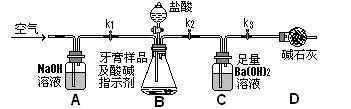
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有______
(4)C中反应生成BaCO3的化学方程式是__________________________
(5)下列各项措施中,不能提高测定准确度的是_________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体; b.滴加盐酸不宜过快;
c.在A—B之间增添盛有浓硫酸的洗气装置
d.在B—C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为_________。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是
_________________________________________________________________________。
为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如下图所示的实验装置,按要求回答问题。
(1)请根据甲同学的意图,连接相应的装置,接口的顺序:b接______,_______接______,______接a。
(2)U形管中所盛试剂的化学式为_________________。
(3)装置③中CCl4的作用是________________。
(4)乙同学认为甲同学实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加装置⑤。你认为装置⑤应加在_______之间(填装置序号)。瓶中可以放入______________________________________________________。
(5)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中AgNO3溶液换成其它溶液。你认为可将溶液换成_____________,如果观察到_____________________的现象,则证明制Cl2时有HCl挥发出来。
熟悉和使用中学化学实验中常见仪器及用品,是化学学习的基本要求。试回答以下问题:
(1)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体。可供选择的液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液。请回答下列问题:
①若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B为无色液体,则试剂A为_________,制取该气体利用了B的性质有_______、______________。
通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满。若石蕊溶液变蓝,则烧瓶中应加入的固体试剂A为_______________________。
②若在乙中收集氨气,气体流经装置的顺序是:a→______→_____→d(填接口代号)
(2)下图中的装置D是实验室制备CO2的简易装置图,用该装置制备CO2可起到随时使反应发生,也可以随时使反应停止的效果。下图中的装置A、B、C也可起到相同效果的有__________(填写编号)。
实验室制配0.4mol/L的NaCl溶液100 mL,有以下仪器:①烧杯 ②100 mL量筒 ③1000 mL容量瓶 ④500 mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码) ⑦药匙
(1)配制时,还缺少的仪器是____________。
(2)应称取的NaCl固体的质量是____________克。
(3)实验两次用到玻璃棒,其作用分别是:
_____________、____________。
⑷配制时,一般过得程是:①计算 ②称量 ③溶解 ④冷却 ⑤转移 ⑥洗涤 ⑦摇匀 ⑧定容 ⑨摇匀。其中最后一次摇匀的方法是_____________(a、左右旋转摇匀B、上下颠到反复摇匀)