学习小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
Ⅰ.摩擦剂中氢氧化铝的定性检验: 取适量牙膏样品,加水搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是____
____________________________________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是_____
_____________________________________________________________________。
Ⅱ.牙膏样品中碳酸钙的定量测定:利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。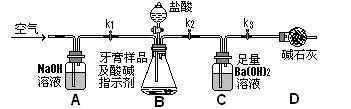
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有______
(4)C中反应生成BaCO3的化学方程式是__________________________
(5)下列各项措施中,不能提高测定准确度的是_________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体; b.滴加盐酸不宜过快;
c.在A—B之间增添盛有浓硫酸的洗气装置
d.在B—C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为_________。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是
_________________________________________________________________________。
某学习小组用图示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。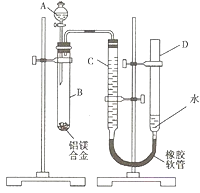
(1)A中试剂为 。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是 。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂;⑤检查气密性。上述操作的顺序是 (填序号);记录C的液面位置时,除视线平视外,还应 。
(4)B中发生反应的化学方程式为
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为 。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将 (填“偏大”“偏小”或“不受影响”)。
某学习小组利用铁与稀硫酸的反应,进行“探究影响化学反应速率因素”的实验。结果如下表:
| 实验 序号 |
铁的质量/g |
铁的 形态 |
V(H2SO4) /mL |
c(H2SO4) /mol·L-1 |
反应前溶液 的温度/℃ |
金属完全消 失的时间/s |
| 1 |
0.10 |
片状 |
50 |
0.8 |
20 |
200 |
| 2 |
0.10 |
粉状 |
50 |
0.8 |
20 |
25 |
| 3 |
0.10 |
片状 |
50 |
1.0 |
20 |
125 |
| 4 |
0.10 |
片状 |
50 |
1.0 |
35 |
50 |
请分析上表信息,回答下列问题。
(1)实验1、2 表明 对反应速率有影响,其规律是 。
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号)。
(3)该探究实验中,影响反应速率的因素还有 ,体现该影响因素的实验有 (填实验序号)。
(4)进行实验3时,若将稀硫酸改为50 mL 2.0 mol·L-1 盐酸(其他条件不变),发现:放出气泡的速率,盐酸明显比硫酸快。你认为可能的原因是。
(忽略温度对反应速率的影响)
某化学小组采用类似制乙酸乙酯的装置(如下图),以环己醇制备环己烯

| 密度 (g/cm3) |
熔点 (℃) |
沸点 (℃) |
溶解性 |
|
| 环己醇 |
0.96 |
25 |
161 |
能溶于水 |
| 环己烯 |
0.81 |
-103 |
83 |
难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从_________口进入。蒸馏时要加入生石灰,目的是_____________。
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是()
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
A.用酸性高锰酸钾溶液 B.用金属钠 C.测定沸点
已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
30 |
120 |
280 |
350 |
370 |
反应速率最大的(填0~1、1~2、2~3、3~4、4~5min)时间段为。原因是。
②反应速率最小的时间段为,原因是
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率。
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他的做法可行的是(填相应字母);做法不可行的是(填相应字母),做法不可行的理由是。
为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如图所示的实验装置,按要求回答问题: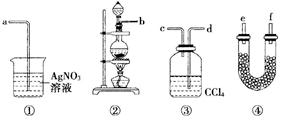
(1)请根据甲同学的意图,连接相应的装置,接口顺序:b接,接,接
。
(2)U形管中所盛试剂的化学式为。
(3)装置③中CCl4的作用是。
(4)乙同学认为甲同学实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种,为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加装置⑤。你认为装置⑤应加在之间(填装置序号)。瓶中可以放入。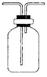
(5)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成其他溶液。你认为可将溶液换成,如果观察到现象,则证明制Cl2时有HCl挥发出来。