海水水资源的利用和海水化学资源的开发利用具有非常广阔的前景。
(1)列举海水淡化的两种方法:________、 。
(2)采用“空气吹出法”从浓海水吹出Br2,用SO2吸收,则发生反应的离子方程式为 。还可以用纯碱吸收,主要反应是Br2+Na2CO3+H2O → NaBr+NaBrO3+NaHCO3,当吸收1 mol Br2时,转移电子的物质的量为________mol。
(3)按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
下列说法正确的是________。
| A.步骤(1)需要过滤装置 | B.步骤(2)需要用到分液漏斗 |
| C.步骤(3)需要用到坩埚 | D.步骤(4)需要蒸馏装置 |
某烃A、B的分子式均为C6H10,它们的分子结构中无支链或侧链。
(1)A为环状化合物,它能与Br2发生加成反应,A的名称是________。
某烯烃1 mol与H2加成后产物为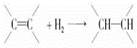 ,则原烯烃可能的结构简式为________________________。
,则原烯烃可能的结构简式为________________________。
CO、CH4均为常见的可燃性气体。
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是________。
(2)120 ℃、101 kPa下,a mL由CO、CH4组成的混合气体在b mL O2中完全燃烧后,恢复到原温度和压强。
①若混合气体与O2恰好完全反应,产生b mL CO2,则混合气体中CH4的体积分数为____________(保留2位小数)。
②若燃烧后气体体积缩小了a/4 mL,则a与b关系的数学表示式是_____________。
已知萘是最简单的稠环芳香烃,其分子式为C10H8,结构式则可以看成为两个苯环共用两个相邻的碳原子,故它在化学性质上与苯有许多类似之处,现有一定量的萘,在一定条件下可以发生下列转化:
(1)请写出C10H7SO3H可能的结构简式:_____________________。
(2)写出发生反应的化学方程式__________________________________________________。
请认真阅读下列三个反应:
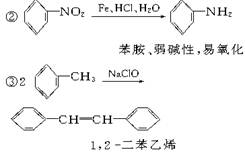
利用这些反应,按以下步骤可从某烃A合成一种染料中间体DSD酸。(试剂和条件已略去)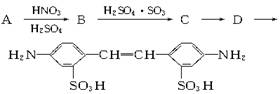
请写出A、B、C、D的结构简式。
A_______________; B______________C___________;D_________________。