铁、铝、铜及其化合物在生产、生活中有着广泛的应用。请回答下列问题:
(1)铝元素在周期表中位置 ,铝离子的结构示意图为 。
(2)Fe3+、Al3+、Cu2+三种金属阳离子氧化性由强到弱的排列顺序是 。制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,该反应的离子方程式为 。
(3)与明矾相似,硫酸铁也可用作净水剂,但在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是 。
(4)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是 (填字母序号)。
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
| A |
铁是地壳中含量最高的金属元素 |
铁是人类最早使用的金属材料 |
Ⅰ对;Ⅱ对。 |
| B |
铝箔在酒精灯火焰上加热熔化但不滴落 |
铝箔对熔化的铝有较强的吸附作用 |
Ⅰ对;Ⅱ错。 |
| C |
铝粉可以和氧化铁粉末发生铝热反应 |
铝热反应是工业炼铁最常用方法 |
Ⅰ对;Ⅱ错。 |
| D |
铜在潮湿空气中表面会生成铜绿 |
可用铜容器盛放浓硫酸 |
Ⅰ对;Ⅱ对。 |
(5)某校兴趣小组为测定一种铁铝硅合金(FexAlySiz)粉末的组成,提出如下方案:准确称取1.46 g该合金粉末,加入过量盐酸,充分反应后过滤,测得剩余固体的质量为0.07 g。向滤液中滴加足量NaOH浓溶液,充分搅拌、过滤、洗涤得到固体。再将所得固体充分加热、灼烧,得到红棕色粉末1.60 g。通过计算确定此合金的组成为________(填化学式)。
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是________________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为________________
(3)根据上述反应可推知________________ (填序号)。
a.氧化性:H3AsO4>HBrO3 b.氧化性:KBrO3>H3AsO4
c.还原性:AsH3>X d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目。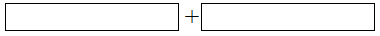
选择下列实验方法分离物质,将分离方法的字母填在横线上
A萃取分液法 B加热分解法 C重结晶法
D分液法 E蒸馏法 F过滤法
(1)________分离饱和食盐水和沙子的混合物
(2)________从硝酸钾和氯化钠的混合溶液中获得硝酸钾
(3)________分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物
(4)________分离水和植物油的混合物
在一定温度下将3 mol CO2和2 mol H2混合于2 L的密闭容器中,发生如下反应:
CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
(1)该反应的化学平衡常数表达式K=________。
(2)已知在700 ℃时,该反应的平衡常数K1=0.6,则该温度下反应CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数K2=_____,反应
CO2(g)+H2(g)的平衡常数K2=_____,反应 CO2(g)+
CO2(g)+ H2(g)
H2(g)
 CO(g)+
CO(g)+ H2O(g)的平衡常数K3=________。
H2O(g)的平衡常数K3=________。
(3)已知在1 000 ℃时,该反应的平衡常数K4为1.0,则该反应为________反应(填“吸热”或“放热”)。
(4)能判断该反应达到化学平衡状态的依据是________。
| A.容器中压强不变 |
| B.c(CO2)=c(CO) |
| C.生成a mol CO2的同时消耗a mol H2 |
| D.混合气体的平均相对分子质量不变 |
(5)在1 000 ℃下,某时刻CO2的物质的量为2.0 mol,则此时v(正)________v(逆)(填“>”、“=”或“<”)。该温度下反应达到平衡时,CO2的转化率为________。
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2(g)+Cl2(g)="2HCl" (g)△H=﹣185kJ/mol,E(H﹣H)="436kJ/mol," E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=
(3)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
①图中△H= KJ·mol-1;
②该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?
(4)①如图是N2和H2反应生成2mol NH3过程中能量变化示意图,请计算每生成1mol NH3放出热量为: .
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为 ;若在同体积的容器中充入2mol N2和6mol H2,达平衡后放出的热量为Q2 kJ,则Q2 2Q1(填“>”、“<”或“=”)
有如下化学反应:2A(g)+B(g) 2C(g),△H<0。
2C(g),△H<0。
(1)若将4 mol A和2 mol B在2 L的容器中混合,经2 s后测得C的浓度为0.6 mol/L,用物质A表示的平均反应速率为_____;2s时物质B的浓度为__________;
(2)若将4 mol A和2 mol B加入体积不变的容器中,一定温度下达到平衡状态,测得气体总物质的量为4.2 mol。此时,混合气体中C的体积分数为__________;若再通入少量B气体,体系中A的物质的量_________(填“增大”、“减小”或“不变”),若要使A的物质的量再达到与原平衡状态相同,可采取的三种措施有 、 、