卤族元素的单质和化合物很多,请用物质结构与性质的相关知识回答:
(1)在一定浓度的氢氟酸溶液中,存在(HF)n缔合分子,使HF分子缔合的作用力是___。
(2)ClO4-中心氯原子的杂化方式为_____,离子的立体构型为__________。
(3)已知碘酸(HIO3)和高碘酸(H5IO6)的分子结构分别如图I、II所示:请比较酸性强弱:HIO3_____H5IO6(填“>”、“<”或“=”)。H5IO6分子中σ键与π键的个数比为 。
(4)下图为碘晶体晶胞结构。有关说法中正确的是___。
| A.用均摊法可知平均每个晶胞中有4个碘原子 |
| B.碘晶体中分子的配位数为12,具有分子密堆积特征 |
| C.碘晶体中存在的相互作用有非极性键和范德华力 |
| D.碘晶体中碘分子有3种排列方向 |
(5)观察CaF2晶胞结构,判断F-占据Ca2+ 形成的 面体空隙中,Ca2+ 占据F-形成的 面体空隙中。若相邻两个Ca2+ 的核间距为a cm,晶胞密度为ρ g/cm3,NA为阿伏加德罗常数,则CaF2的摩尔质量可以表示为________g/mol。
由短周期元素组成的A、B、C、D、E、F六种微粒,其中只有C、D是分子,其余四种是离子,且每个微粒中都含有10个电子。已知A、E是由非金属元素组成的阳离子,六种微粒间有下列关系:
①A、B两种离子在加热条件下可生成C、D两种分子;
②通常状况下C的聚集状态为气态,且可使湿润的红色石蕊试纸变蓝;
③1 mol B离子与1 mol E离子作用可生成2 mol D分子;
④向含F离子的溶液中加入C的溶液,可生成白色沉淀W,C溶液过量沉淀也不消失,但再加入含大量B离子或大量E离子的溶液,沉淀W都会溶解。
(1) 微粒A的化学式是_____________;微粒E的名称是___________________。构成微粒F的元素在元素周期表中的位置是____________________________。
(2) 写出F与过量C溶液反应的离子方程式:_________________________
(3) 写出由C的水溶液制[Cu(NH3)4]SO4·H2O晶体的两个主要离子反应方程式:
(8分)有下列九种晶体,完成下列各小题。
①金刚石 ②C60 ③锌④晶体氖 ⑤氯化铵 ⑥金刚砂 ⑦冰醋酸 ⑧干冰 ⑨氧化钠
(1)属于分子晶体的是________,属于原子晶体的是________,属于离子晶体的是________。
(2)属于电解质的是________。
(3)直接由原子构成的晶体是________。
(4)含有极性共价键的晶体是________。
(5)晶体中有氢键的是________________,受热熔化需克服共价键的是________。
某些化学键的键能如下表所示(kJ·mol-1):
| 键 |
H-H |
Br-Br |
I-I |
Cl-Cl |
H-Cl |
H-I |
H-Br |
| 键能 |
436 |
193 |
151 |
247 |
431 |
299 |
356 |
(1)把1mol Cl2分解为气态原子时,需要_______(填“吸收”或“放出”) ________能量
(2)1mol H2在2mol Cl2中燃烧,放出的热量_______KJ。
(3)由表中所列化学键形成的单质分子中,最稳定的是________,最不稳定的是________,形成的化合物分子中,最稳定的是__________,最不稳定的是__________.
(4)在一定条件下,1mol H2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的是____。
A.Cl2 > Br2 > I2 B.I2 > Br2 > Cl2
(5)预测1mol H2在足量F2中燃烧比在Cl2中放热。
(6)在液态HCl、HBr、HI中沸点最高的是。
A为常见烃是一种水果催熟剂,乙酸苯甲酯可提高花或果的芳香气味,常用于化妆品工业和食品工业。下图是乙酸苯甲酯的一种合成路线(部分反应物、产物和反应条件略去)。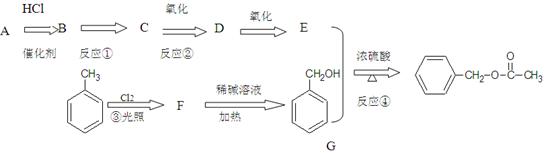
请回答:
(1)E的官能团名称为F的结构简式为
(2)反应①条件为,反应④的类型是
(3)反应②的化学方程式为;反应类型是
(4)物质D与新制氢氧化铜反应方程式为
(5)G有多种同分异构体,其中属于芳香族化合物的有种(不包括G)
写出其中的任意一种同分异构体的结构简式
回答下列问题:
① CH2=CH-CH=CH2 键线式__________②羟基(-OH)的电子式_____________
③ 的结构简式___________④芳香烃萘
的结构简式___________④芳香烃萘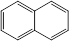 的分子式为
的分子式为