实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化。
(1)关于该反应的下列说法中,正确的是_________(填字母)。
A.ΔH<0,ΔS<0 B.ΔH>0,ΔS<0
C.ΔH>0,ΔS>0 D.ΔH<0,ΔS>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,H2的平均反应速率v(H2)= ;CO2的转化率w(CO2)= 。
②该反应的平衡常数K= 。(只列表达式和计算式,不必计算出结果)
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.将CH3OH(g)及时液化抽出 B.升高温度
C.选择高效催化剂 D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16 g 液态甲醇完全燃烧,当恢复到原状态时,放出350.8kJ的热量,写出该反应的热化学方程式: 。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,其负极的电极反应式是: 。
碳正离子〔如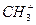 、
、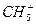 、(CH3)3C+等〕是有机反应中重要的中间体,欧拉(G.olah)因在此领域研究中的卓越成就而荣获1994年的诺贝尔化学奖。
、(CH3)3C+等〕是有机反应中重要的中间体,欧拉(G.olah)因在此领域研究中的卓越成就而荣获1994年的诺贝尔化学奖。
碳正离子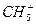 可以通过CH4在“超强酸”中再获得一个H+而得到,而
可以通过CH4在“超强酸”中再获得一个H+而得到,而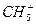 失去H2可得
失去H2可得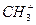 。
。
(1)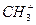 是反应性很强的正离子,是缺电子的,其电子式是_____________。
是反应性很强的正离子,是缺电子的,其电子式是_____________。
(2)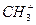 中4个原子是共平面的,三个键角相等,键角应是_____________(填角度)。
中4个原子是共平面的,三个键角相等,键角应是_____________(填角度)。
(3)(CH3)2CH+在NaOH的水溶液中反应将得到电中性的有机分子,其结构简式是________。
(4)(CH3)3C+去掉H+后将生成电中性的有机分子,其结构简式是_____________。
某饱和一元醇的分子式为CnH2n+2O。
(1)若该醇没有同分异构体,则该醇的结构简式为:______________________________。
(2)若该醇有同分异构体,且各同分异构体分别跟浓H2SO4加热发生消去反应生成同一种烯烃,则该醇的分子式为:_____________________________,其同分异构体的结构简式分别为:__________________________________________。
已知:①四烃基乙二醇在H2SO4作用下可经重排反应生成片呐酮: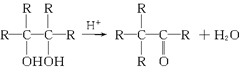 片呐酮可在
片呐酮可在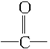 上与H2发生加成反应。
上与H2发生加成反应。
②醇发生消去反应时,羟基优先跟相邻含氢较少的碳上的氢一起消去生成烯烃,如: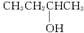
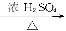 CH3CHCHCH3+H2O
CH3CHCHCH3+H2O
③卤代烃在热的酸性溶液中水解生成醇: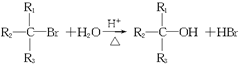
试根据下列转化关系,回答有关问题: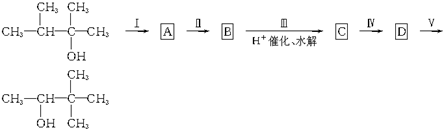
则B的结构简式为________,反应Ⅰ—Ⅴ中属于加成反应的是________(填序号)。
有机物结构理论中,若一个碳原子同时含有两个羟基时,结构很不稳定,会自动脱水生成相应的醛: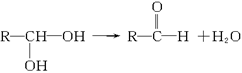
试写出甲烷与氯气光照后生成的一系列有机物中,在一定条件下与NaOH溶液共热后生成物的结构简式为:①____________、②___________、③___________、④___________。
化学式C8H10O的化合物A具有如下性质:
①A+Na 慢慢产生气泡②A+RCOOH
慢慢产生气泡②A+RCOOH 有香味的产物③A
有香味的产物③A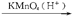 苯甲酸④其催化脱氢产物不能发生银镜反应⑤脱水反应的产物,经聚合反应可制得一种塑料制品(它是目前造成“白色污染”的主要污染源之一)。
苯甲酸④其催化脱氢产物不能发生银镜反应⑤脱水反应的产物,经聚合反应可制得一种塑料制品(它是目前造成“白色污染”的主要污染源之一)。
试回答:
(1)根据上述信息,对该化合物的结构可作出的判断是_____________;
| A.苯环上直接连有羟基 | B.苯环侧链末端有甲基 |
| C.肯定有醇羟基 | D.肯定是芳香烃 |
(2)化合物A的结构简式_____________;
(3)A和金属钠反应的化学方程式_______________________________________。