(一)对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。下表为几种弱酸在25℃时的电离平衡常数
回答下列问题:
(1)K只与温度有关,当温度升高时,K值____(填“增大”、“减小”、“不变”)。
(2)从电离的角度,HCO3-、HPO42-、H2PO4-都可看作是酸,其中酸性最强的是_________,最弱的是________。
(3)对于同一种多元弱酸,有不止一个电离平衡常数,多个常数K1、K2、K3、之间存在某种大小关系,此关系是________;以碳酸为例,用离子方程式和必要的文字说明产生此规律的原因______ _。
(4)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L的 的电离转化率为____,则该温度下醋酸的电离平衡常数
的电离转化率为____,则该温度下醋酸的电离平衡常数 _____。
_____。
(二)化合物SOCl2是一种液态化合物,沸点77 ℃。在盛有10 mL水的锥形瓶中,小心地滴加8~10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出。该气体可使滴有品红试液的滤纸褪色。
(1)写出SOCl2和水反应的化学方程式:_____________________________。
(2)把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是 ;用SOCl2与AlCl3·6H2O混合共热得到无水AlCl3,原因是________________________ 。
如图为以惰性电极进行电解:
(1)写出A、B、C、D各电极上的电极方程式:
A____________________________________________,
B____________________________________________,
C____________________________________________,
D____________________________________________。
(2)在A、B、C、D各电极上析出生成物的物质的量之比为______________________。
在烷烃分子的基团:—CH3、—CH2—、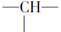 、
、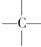 中的碳原子分别称为伯、仲、叔、季碳原子;数目分别用n1、n2、n3、n4表示。如
中的碳原子分别称为伯、仲、叔、季碳原子;数目分别用n1、n2、n3、n4表示。如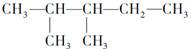 分子中n1=4、n2=1、n3=2、n4=0。试根据不同烷烃的组成和结构,分析出烷烃(除甲烷外)中各原子数的关系。
分子中n1=4、n2=1、n3=2、n4=0。试根据不同烷烃的组成和结构,分析出烷烃(除甲烷外)中各原子数的关系。
(1)若烷烃分子中氢原子数为A,A与n1、n2、n3、n4的关系是:
A=_______________,或A=____________。
(2)若分子中n2=n3=n4=1,则该分子的结构简式可能是____________。
(3)四种碳原子数之间的关系是:n1=____________。
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。完成下列各题:

(1)正四面体烷的分子式为,其二氯取代产物有种。
(2)关于乙烯基乙炔分子的说法错误的是。
a.能使
酸性溶液褪色
b.1
乙烯基乙炔能与3
发生加成反应
c.乙烯基乙炔分子内含有两种官能团
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式:。
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例):、。
已探明我国锰矿储量占世界第三位,但富矿仅占6.4%,每年尚需进口大量锰矿石。有人设计了把我国的菱锰矿(MnCO3)(贫矿)转化为高品位“菱锰矿砂(MnCO3)”的绿色工艺。该工艺流程如下图所示:
回答下列问题:
(1)气体A中含有两种气体,溶液C与气体A发生反应的化学方程式为________________。
(2)锰的化合物用途广泛,例如MnO2、KMnO4都是重要的锰化合物。MnO2可用于制备KMnO4,一般是先由MnO2在碱性条件下与O2反应制备得到K2MnO4,再由K2MnO4通过以下两种方式制备KMnO4。
方法一:电解法:2K2MnO4+2H2O 2KMnO4+2KOH+H2↑
2KMnO4+2KOH+H2↑
方法二:CO2法:3K2MnO4+2CO2====2KMnO4+MnO2↓+2K2CO3
①写出MnO2得到K2MnO4的化学方程式:_______________________________。
②以上两种制备方法,方法一相对于方法二,所具有的优点是_______________________。
③KMnO4粉末在低温下与浓硫酸作用,可生成油状液体,它在0 ℃以下是稳定的,室温下会立即发生爆炸分解,分解产物为MnO2和O2,则该物质的化学式为_________________。
铅蓄电池(原电池)的电极分别为PbO2和Pb,电解质溶液为稀硫酸溶液,工作时原电池的总反应是:PbO2+Pb+2H2SO4 2PbSO4+2H2O,根据上述变化,判断:
2PbSO4+2H2O,根据上述变化,判断:
(1)原电池的负极是________(填电极材料);
(2)工作时蓄电池正极反应为________________________________;
(3)工作时蓄电池里电解质溶液pH________ (选填增大,不变,变小)。