维生素C的结构简式为 ,有关它的叙述错误的是
,有关它的叙述错误的是
| A.是一个环状的酯类化合物 | B.易起氧化及加成反应 |
| C.可以溶解于水 | D.在碱性溶液中能稳定地存在 |
(1)(3分)有下列有机物:
a.  b.
b. 
c.  d.
d. 
①互为同分异构体的是_______________。
②互为同系物的是_______________。
③核磁共振氢谱只有一个峰的是_______________。
(2)(6分)柠檬酸结构简式为:
①柠檬酸中的官能团有____________。
②1 mol柠檬酸最多可消耗NaOH溶液的物质的量为_______________mol。
③柠檬酸不能发生的反应为_______________。
a.酯化反应 b.加成反应 c.氧化反应 d.消去反应 反应①、③消耗Br2的物质的量之比为___________;物质B的结构简式为_____________。
反应①、③消耗Br2的物质的量之比为___________;物质B的结构简式为_____________。
(15分)本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做1题。若两题都作答,则以A题计分。
A.《化学与生活》
⑴(3分)随着工业化、城镇化的快速发展,我们所生存的环境也面临越来越严峻的污染问题,如酸雨的形成、汽车尾气污染、工业废气污染、大量生活垃圾的产生等。
①下列措施不能够改善环境质量的是(填字母)。
a.对所有垃圾通过露天焚烧的方式进行处理
b.给汽车排气管加装尾气催化净化装置以减少尾气污染
c.在煤炭中添加生石灰以减少酸雨的发生
②城市空气质量监测中,不需要监测的指标的是(填字母)。
a.SO2浓度 b.NOx浓度 c.可吸入颗粒物的含量 d.CO2浓度
③现代人已经进入以“室内污染”为标志的第三个污染阶段,以下不属于室内污染物的是
(填字母)。
a.烹饪时产生的油烟 b.石材缓慢释放的放射性气体
c.各种板材中粘合剂释放的甲醛等 d.天然气燃烧产生的CO2和水
⑵(6分)化学与新材料开发密切关联,化学是人类进步的关键。
①近日,《中国航空报》透露了一条重大消息,中国在先进高温合金领域不断获得重大成果。可以说,没有高温合金,就没有今天先进的航空发动机。下列物质中不属于合金的是(填字母)。
a.硬铝 b.玻璃钢 c.不锈钢 d.黄铜
②新型有机玻璃透光性好,质轻,耐酸、碱,易于加工成型,强度高,安全性好。有机玻璃属于(填“合成纤维”、“合成橡胶”或“塑料”)材料。环保型聚乙烯塑料袋可以用于食品包装,合成该聚合物的反应可表示为。
③随着电解工业的发展,铝制品已经被人类广泛使用,但是常温下不可以用铝制容器盛装的是(填字母)。
a.浓氢氧化钠溶液 b.浓硫酸 c.浓硝酸 d.啤酒
在室外,不能将铜质电线和铝质电线直接相连接,否则会因发生腐蚀而形成安全隐患。
⑶(6分)合理膳食,保持营养均衡,合理使用药物是青少年学生健康成长的重要保证。
①维生素C能增强人体对疾病的抵抗能力,促进人体生长发育。在氯化铁溶液中加入维生素C溶液后,溶液由黄色转变为浅绿色,说明维生素C具有性。
②(填字母)具有止咳平喘作用,可用于治疗支气管哮喘、鼻粘膜充血引起的鼻塞等。
a.麻黄碱 b.阿司匹林 c.抗酸药 d.青霉素
③人们每天摄取的热能中大约有75%来自糖类,淀粉是一种重要的多糖,它在人体内水解的最终产物是(填分子式)。碘元素是人体必需的微量元素之一,有“智力元素”之称,目前,我国通过在食盐中加入(填化学式)从而达到补碘的效果。生物制药中往往涉及到活性蛋白质的提纯,可以采用的一种方法是(填“过滤”、“高温蒸馏”或“盐析”)。淀粉、纤维素、油脂、蛋白质中不属于天然高分子的是。
经测定某苯的含氧衍生物相对分子质量为122。
(1)若该物质分子中只含一个氧原子,则其化学式为,如果其分子中没有甲基,则它遇FeCl3溶液(填“能”或“不能”)发生显色反应,如果其遇FeCl3溶液会发生显色反应,则这样的结构共有种。
(2)若该物质分子中含有两个氧原子,则其化学式为,其可能的结构共有
种,其中用水能与其他同分异构体区别出来的是(写出结构简式)。
含有C、H、O的化合物,其C、H、O的质量比为12∶1∶16,其蒸气相对于氢气的密度为58,它能使甲基橙溶液变红,也能使溴水褪色,0.58g这种物质能与50mL0.2mol/L的氢氧化钠溶液完全反应。试回答:
(1)该有机物中各原子个数比N(C)∶N(H)∶N(O)=
(2)该有机物的摩尔质量为,写出分子式
(3)该有机物的可能结构简式有
多巴胺是一种重要的中枢神经传导物质,用来帮助细胞传送脉冲的化学物质,能影响人对事物的欢愉感受。多巴胺可用香兰素与硝基甲烷等为原料按下列路线合成: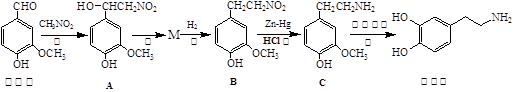
(1)香兰素保存不当往往会导致颜色、气味发生明显变化,其原因是
(2)多巴胺中的官能团的名称是、;反应②的反应条件为
;反应④的反应类型为反应。
(3)写出反应①的化学方程式
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:
①具有天然α-氨基酸的共同结构②能与FeCl3溶液发生显色反应
③有6种不同化学环境的氢原子