(1)与明矾相似,硫酸铁也可用作净水剂,其原理为_________(用离子方程式表示)。
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为___________________。
(3)已知:S2O32—有较强的还原性,实验室可用I-测定K2S2O8样品的纯度,反应方程式为S2O82—+2I-=2SO42—+I2①、I2+2S2O32-=2I-+S4O62—②。S2O82—、S4O62—、I2氧化性强弱顺序:__________。
(4)已知溶液中,还原性为HSO3—>I-,氧化性为IO3—>I2>SO42—。在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示。
a点处的还原产物是__________(填离子符号);
b点→c点反应的离子方程式是__________________。
铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是;X与过量浓硝酸反应后溶液中含有的盐的化学式为。
(2)某溶液中有Mg2+、Fe2 +、A13+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐
+、A13+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐 酸中,所得溶
酸中,所得溶 液与原溶液相比,溶液中大量减少的阳离子是;
液与原溶液相比,溶液中大量减少的阳离子是;
A.Mg2+B.Fe2+C.A13+D.Cu2+
(3)氧化铁是重要工业颜料,用废秩屑制备它的流程如下: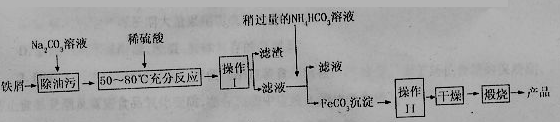
回答下列问题:
①操作I的名称是,操作II的名称是;操作III的
方法为 。
。
②Na2CO3溶液可以除油污,原因是(用离子方程式表示);
③请完成生成FeCO3沉淀的离子方程式。
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定
(5Fe2++MnO-4+8H+====5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需。
②该实验中的KMnO4溶液需要酸化,用于酸化的酸是。
A.稀硝酸 B.稀盐酸 C.稀硫酸 D.浓硝酸
③某同学设计的下列滴定方式,最合理的是。(夹持部分略去)(填字母序号)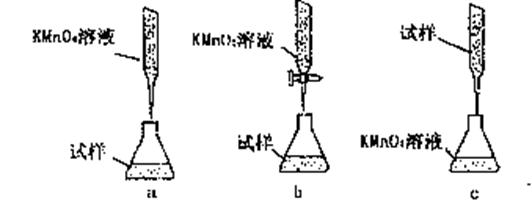
2010年10月1日,我国利用“长三丙”火箭成功发射“嫦娥二号”探月卫星。
(1)火箭升高时,由于与大气层的剧烈摩擦产生高温。为了防止火箭温度过高,在火箭表面涂上一层特殊的涂料,该涂料的性质最可能是。
| A.在高温下不融化 | B.在高温下可分解气化 |
| C.在常温下就分解气化 | D.该涂料不可能发生分解 |
(2)火箭常用N2O4和N2 H4作为燃料,请配平其反应的方程式:
H4作为燃料,请配平其反应的方程式:
N2O4+N2H4=N2+H2O
(3)不久我国准备发射探月飞船,为了向宇航员提供氧气,飞船上有专门的供氧装置。现提供有供氧剂Na2O2与KO2。
①写出KO2与CO2反应的化学方程式。
②你认为最佳的供氧剂是,理由是。
某课外活动小组进行下列实验(如下图所示)。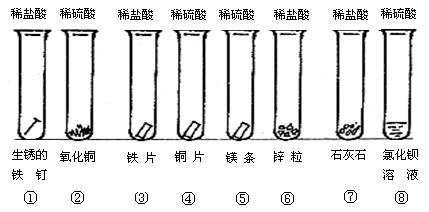
(1)某同学将这些实验分成三组,各组的试管编号是:第一组①②;第二组③④⑤⑥;第三组⑦⑧。
你认为如此分组的依据是:。
(2)写出试管②⑤⑧的实验现象及有关的离子方程式:
②;。
⑤;。
⑧;。
从下列各组反应对比中,判断哪种粒子的氧化性最强,哪种粒子的还原性最强.
(1)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质,则Cu、Fe、Ag中,___________还原性最强;Cu2+、Fe2+、Ag+中,_______________氧化性最强。
(2)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成淡绿色溶液(FeCl2)。则氯气分子、氯离子、氢离子中_____________具有氧化性,___________氧化性最强。
写出下列电离方程式或反应的离子方程式
(1)硫酸铝电离的电离方程式 ________________:
(2)向澄清石灰水中加硝酸 ________________;
(3)用石灰石与盐酸反应制取二氧化碳 _________________;
(4)锌粉加入硫酸溶液中 _______________;
(5)向Na2CO3溶液中滴加几滴稀盐酸: _______________。