一定条件下的可逆反应2NO2 (g)  N2O4 (g) △H=" -92.4kJ/mol " 达到化学平衡状态且其它条件不变时,
N2O4 (g) △H=" -92.4kJ/mol " 达到化学平衡状态且其它条件不变时,
(1)如果升高温度,平衡混合物的颜色 ;(变深、变浅)
(2)如果在体积固定的容器中加入一定量的二氧化氮,化学平衡向 方向移动。
工业上制备 BaC12 的工艺流程图如图所示:
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得: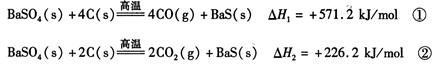
(1)反应C(s) + CO2(g) 2CO(g)的△H =kJ/mol
2CO(g)的△H =kJ/mol
(2)过滤过程中需要使用玻璃棒,玻璃棒的作用是。
(3)盐酸溶解焙烧的固体后,产生的气体用过量 NaOH 溶液吸收,得到硫化钠溶液。 Na2S 水解的离子方程式为。
(4)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,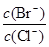 =。[已知:
=。[已知:
Ksp(AgBr) = 5.4×10─13 , Ksp(AgCl) = 2.0×10─10]
工业上制备H2的一种重要方法是: CO(g) + H2O(g)  CO2 (g) + H2(g)△H=Q kJ/mol 。已知该反应的平衡常数K与温度T的关系如图所示。若在一固定的密闭容器中, 850℃ 时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表:
CO2 (g) + H2(g)△H=Q kJ/mol 。已知该反应的平衡常数K与温度T的关系如图所示。若在一固定的密闭容器中, 850℃ 时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表: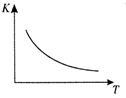
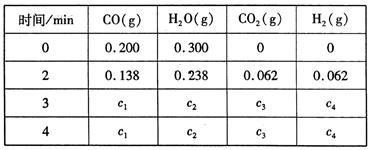
已知:850℃ 时该反应的化学平衡常数K ="1.0" ,请回答下列问题:
(1)Q 0(填“ > ”、“ = ”或“<” )。
(2)可以判断该反应达到化学平衡状态的叙述是(填字母)。
| A.单位时间内减少 CO(g)的浓度等于生成 CO2 (g)的浓度 |
| B.反应容器内的压强不发生变化 |
| C.混合气体中 H2 (g)的浓度不再发生改变 |
| D.氢气的生成速率等于水的生成速率 |
(3)若在850 ℃时向反应容器中充人H2O(g) , K 值(填“增大”、“减小”或“不变”)。
(4)上表中 c2为mol/L , CO(g)的转化率为
化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列 △ H 表示物质燃烧热的是(填字母编号)。

(2)依据上述热化学方程式,稀硝酸与氢氧化钾溶液发生中和反应的热化学方程式为(其中热效应从上述 △H1 ~△H7尽中选取)。
(3)中和热的测定是高中化学的定量实验之一。 50 mL0.50 mol/L 盐酸与 50 mL 0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。从实验装置上看,图中尚缺少的一种仪器是。大烧杯上如不盖硬纸板,求得的中和热数值将会(填“偏大”、“偏小”或“无影响”)。
试样X由氧化亚铁和氧化铜组成,取质量相等的两份试样按下图进行实验:
(1)请写出步聚③中发生的全部反应的离子方程式:____________________________________。
(2)要使试样X转变为粉末Z。除了CO外,还可以使用。
| A.氢气 | B.焦炭 | C.氯气 | D.氧气 |
(3)若全部的溶液Y和全部的粉未Z充分反应,生成的不溶物W的质量是m,则每份试样X中氧化铜的质量为(用m表示):。
某些化学反应可用下式表示:A+B→C+D+H2O
请回答下列问题(反应可以是固体之间的反应,也可以是在水溶液中进行的反应):
(1)若A是非金属气态单质,反应后所得溶液常用于消毒、杀菌。则A为(填化学式下同)。反应的化学方程式为。
(2)若A为非金属固态单质,C、D均为气体且都能使澄清石灰水变浑浊。则A为。反应的化学方程式为。
(3)若A为紫红色金属,D为有色气体。则A为。反应的离子方程式为。
(4)若A为烧碱溶液,C是相对分子质量为100的白色沉淀,D为正盐。则C为。反应的离子方程式为。
(5)若A、B为固体,C的水溶液能使酚酞溶液变为红色。实验室常用此反应制备C气体。则C为。反应的化学方程式为。