工业上制备H2的一种重要方法是: CO(g) + H2O(g)  CO2 (g) + H2(g) △H=Q kJ/mol 。已知该反应的平衡常数K与温度T的关系如图所示。若在一固定的密闭容器中, 850℃ 时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表:
CO2 (g) + H2(g) △H=Q kJ/mol 。已知该反应的平衡常数K与温度T的关系如图所示。若在一固定的密闭容器中, 850℃ 时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如下表: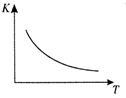
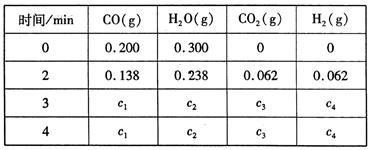
已知:850℃ 时该反应的化学平衡常数K ="1.0" ,请回答下列问题:
(1)Q 0(填“ > ”、“ = ”或“<” )。
(2)可以判断该反应达到化学平衡状态的叙述是 (填字母)。
| A.单位时间内减少 CO(g)的浓度等于生成 CO2 (g)的浓度 |
| B.反应容器内的压强不发生变化 |
| C.混合气体中 H2 (g)的浓度不再发生改变 |
| D.氢气的生成速率等于水的生成速率 |
(3)若在850 ℃时向反应容器中充人H2O(g) , K 值 (填“增大”、“减小”或“不变”)。
(4)上表中 c2为 mol/L , CO(g)的转化率为
研究化学反应原理对于生产、生活及环境保护具有重要意义。
(1)工业制硫酸的过程中存在反应: 。
。 ℃时,将2mol
℃时,将2mol 和1.5 mol
和1.5 mol 充入2L密闭容器中发生上述反应,容器中
充入2L密闭容器中发生上述反应,容器中 的物质的量随温度变化的曲线如图所示。
的物质的量随温度变化的曲线如图所示。
①图中a点的正反应速率(填写“>”“<”或
“=”)逆反应速率。
②下列条件可以证明上述反应已经达到化学平衡状态的是 (填写序号)
a.单位时间内消耗1mol ,同时生成2mol
,同时生成2mol
b.容器内 、
、 、
、 的浓度之比为2∶1∶2
的浓度之比为2∶1∶2
c.容器内压强保持不变
d.混合气体的平均相对分子质量保持不变
③ ℃时,上述反应的化学平衡常数K= 。
℃时,上述反应的化学平衡常数K= 。
(2)碳酸铵是一种常用的铵态氮肥,其水溶液显碱性,其原因是;溶液中离子浓度关系为 。
。
(3)治理水体重金属离子污染时,首先投入沉淀剂将重金属离子转化为难溶悬浮物,然后再投入氯化铝将污水中的悬浮物除去,从而净化水体,氯化铝的作用是
(用离子方程式表示)。
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。
请回答下列问题:
(1)元素D在周期表中的位置。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型A、B、C三种元素以原子个数比4∶2∶3形成化合物有。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:。
若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:。
(5) 气体有毒,排放到大气中易形成酸雨,写出
气体有毒,排放到大气中易形成酸雨,写出 与氧气和水蒸气反应的化学方程式。
与氧气和水蒸气反应的化学方程式。
Ⅰ 氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布图是_________________。
(2)C、N、O 三种元素第一电离能从大到小的顺序是____________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是_______________;N2H4分子中氮原子轨道的杂化类型是___________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该反应中有4mol N-H 键断裂,则形成的π 键有________mol。
Ⅱ 金属镍在电池、合金、催化剂等方面应用广泛。
(4)第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是______。
(5)甲醛(H2C=O)在Ni 催化作用下加氢可得甲醇(CH3OH)。甲醛分子内C 原子的杂化方式为________。
Ⅲ 氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
(6)写出N2H62+与碱溶液反应的离子方程式;
(7)写出N3-等电子体物质的化学式;(一种)
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为。
②NO3-的空间构型是(用文字描述)。
(2)在铜锰氧化物的催化下,CO 被氧化为CO2,HCHO 被氧化为CO2和H2O。
①根据等电子体原理,CO 分子的结构式为。
②H2O 分子中O 原子轨道的杂化类型为。
③1 mol CO2 中含有的σ键数目为。
某种ABS工程树脂,由丙烯腈(CH2=CHCN,符号A),1,3—丁二烯(CH2=CHCH=CH2,符号B)和苯乙烯( —CH=CH2,符号S)按一定配比共聚而得。
—CH=CH2,符号S)按一定配比共聚而得。
(1) A,B和S三种单体中,碳氢比(C:H)值最小的单体是____________________
(2) 经元素分析可知该ABS样品的组成为CaHbNc(a,b,c为正整数),则原料中A和B的物质的量之比是________________(用a,b,c表示)。