下列实验现象与结论不一致的是
| |
实验操作(或设计) |
实验现象 |
结论 |
| A |
等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 |
HA放出的氢气多且反应速率快 |
酸性:HB > HA |
| B |
以镁、铝、氢氧化钠溶液构成原电池 |
镁表面有气泡 |
镁作原电池的负极 |
| C |
相同温度下,等质量的大理石与等体积等浓度的盐酸反应 |
粉状大理石产生气泡更快 |
反应速率: 粉状大理石>块状大理石 |
| D |
向盛有10滴0.1 mol·L-1 AgNO3溶液的试管中滴加0.1 mol·L-1 NaCl溶液,至不再有沉淀生成,再向其中滴加0.1 mol·L-1 NaI溶液 |
先有白色沉淀,后转成黄色沉淀 |
Ksp(AgCl )> Ksp(AgI) |
下列事实不能用勒夏特列原理解释的是
| A.温度控制在500℃有利于合成氨反应 |
| B.用排饱和食盐水法收集Cl2 |
C.工业制取金属钾 Na(l)+KCl(l)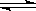 NaCl(l)+K(g)选取适宜的温度,使钾成蒸气从反应混合物中分离出来 NaCl(l)+K(g)选取适宜的温度,使钾成蒸气从反应混合物中分离出来 |
| D.打开碳酸饮料会有大量气泡冒出 |
某学生的实验报告所列出的下列数据中合理的是
| A.用10mL量筒量取7.13mL稀盐酸 |
| B.用托盘天平称量25.20g NaCl |
| C.用广泛pH试纸测得某溶液的pH为2.3 |
| D.中和滴定时用去某浓度的碱溶液21.70mL |
将等物质的量的F2和ClF混合,在密闭容器中发生反应: F2(g)+ClF(g)  ClF3(g);△H<0。下列叙述中正确的是
ClF3(g);△H<0。下列叙述中正确的是
| A.恒温恒容,当ClF 转化40% 时,容器内的压强为初始时的0.8 倍 |
| B.若 c(F2):c (ClF): c (ClF3) ="1:" 1: 1, 则反应一定达到平衡状态 |
| C.达到平衡后,若增大容器体积,则正反应速率减小,逆反应速率增大,平衡左移 |
| D.平衡后再降低温度,保持恒容,达到新的平衡,则混合气体的密度减小 |
反应N2O4(g) 2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。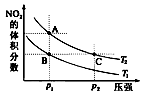
下列说法正确的是
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
下图表示反应X(g) 4Y(g)+Z(g),ΔH<0,在某温度时X的浓度随时间变化的曲线:
4Y(g)+Z(g),ΔH<0,在某温度时X的浓度随时间变化的曲线: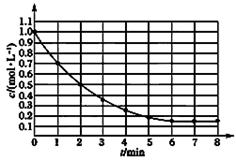
下列有关该反应的描述正确的是
| A.第6min后,反应就终止了 |
| B.X的平衡转化率为85% |
| C.若升高温度,X的平衡转化率将大于85% |
| D.若降低温度,v正和v逆将以同样倍数减小 |