过氧化钙难溶于水,溶于酸生成过氧化氢,在医药上用作杀菌剂、防腐剂等。
Ⅰ.某小组用含有少量氧化亚铁和氧化铁杂质的大理石制取过氧化钙的流程如下:
请回答下列问题:
(1)操作I的目的是调节溶液的pH,使铁元素完全沉淀,则试剂A最好选用 。
a.盐酸 b.硝酸 c.盐酸和过氧化氢 d.硫酸
(2)检验操作I中铁元素已沉淀完全的操作是 。
(3)滤液B主要成分的化学式是 。
(4)反应Ⅱ是放热反应。保持H2O2物质的量一定,当H2O2浓度小于20%时,CaO2的产率随H2O2浓度的增大而增大;但浓度大于20%后,CaO2产率反而下降。试分析CaO2产率下降的可能原因是 。
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量:
步骤1:准确称取0.3900g过氧化钙样品,置于250 mL的锥形瓶中;
步骤2:分别加入10 mL蒸馏水和20 mL磷酸(1:3),振荡使样品完全溶解;
步骤3:用0.1000 mol·L-1 KMnO4标准溶液滴定至终点,记录数据;
步骤4:平行测定4次(数据记录见下表),计算试样中CaO2的质量分数。
| 实验 |
1 |
2 |
3 |
4 |
| V(KMnO4) /mL |
19.50 |
21.50 |
19.48 |
19.52 |
已知:上述实验过程中反应关系为:CaO2~H2O2,5H2O2~2KMnO4
请回答下列问题:
(5)步骤3判断滴定达到终点的现象是 ;
(6)由表中数据可知,该样品中CaO2含量为 %。若实验时刚洗净的滴定管未用KMnO4标准溶液润洗,则CaO2的质量分数测定结果 (填“偏高”、“偏低”或“无影响”)。
(10分)为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签。某学生欲在实验室中配制500 mL该葡萄糖注射液。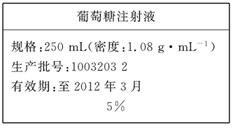
实验用品:葡萄糖晶体(摩尔质量:180 g/mol)、蒸馏水、烧杯、容量瓶(500 mL)、药匙、胶头滴管、量筒。
(1)还缺少的仪器有_。
(2)下列对容量瓶及其使用方法的描述中正确的是__。
A.使用前要检查容量瓶是否漏水
B.容量瓶用蒸馏水洗净后,再用标准葡萄糖注射液润洗
C.配制溶液 时,把称好的葡萄糖晶体小心倒入容量瓶中,加入蒸馏水到接近刻度线1~2 cm处,改用胶头滴管加蒸馏水至刻度线
时,把称好的葡萄糖晶体小心倒入容量瓶中,加入蒸馏水到接近刻度线1~2 cm处,改用胶头滴管加蒸馏水至刻度线
D.容量瓶上标有容积、温度和浓度
(3)实验中需取用晶体的质量为____,物质的量浓度__。
(4)配制0.1 mol/L的NaCl溶液,下列操作会导致所配溶液的物质的量浓度偏高的是__。
A.没有将洗涤液转移到容量瓶 B.定容时俯视读取刻度
C.原容量瓶洗净 后未干燥 D.定容时液面超过了刻度线
后未干燥 D.定容时液面超过了刻度线
18.0 mol·L-1的浓硫酸稀释成2.00 mol·L-1的稀硫酸100 ml,实验操作如下:
(1)计算并用量筒量取ml的18.0 mol·L-1的浓硫酸;
(2)将沿烧杯内壁慢慢注入盛有少量的烧杯中;
(3)将已冷却至室温的硫酸溶液沿玻璃棒注入___________;
(4)用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
(5)继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处,改用胶头滴管逐滴加蒸馏水,至液面与刻度线相切
(6)盖好容量瓶塞,反复颠倒摇匀,将配好的稀硫酸倒入试剂瓶中,贴好标签保存。
试分析下列操作对实验结果的影响(偏高、偏低或无影响)
(1)没有洗涤烧杯和玻璃棒
(2)定容时俯视读数
(3)容量瓶使用前有少许水残留
右图是用自来水制取少量蒸馏水的简易装置,(加热及固定仪器略 ),其原理与教材中的实验完全相同。
),其原理与教材中的实验完全相同。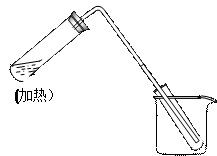
回答下列问题:
(1)左边大试管中要加入几片碎瓷片,其作用是
(2)该装置中使用的玻璃管较长,其作用是
(3)烧杯中还应该加入的物质是
实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的;
(1)溶解时
(2)过滤时
(3)蒸发时
可用于分离或提纯物质的方法有:①过滤 ②蒸馏 ③加热 ④分液(填序号)
(1)除去石灰水中悬浮的CaCO3颗粒
(2)除去NaCl晶体中混有的碘单质
(3)分离石油中各不同沸点范围的成分
(4)分离水和苯的混合物