请回答实验室分馏石油的有关问题:
(1)实验室分馏石油的正确操作顺序是
E→ → →A→ → →G。
| A.连接接液管 |
| B.装入碎瓷片和石油,塞上带温度计的塞子 |
| C.检查装置气密性 |
| D.连接冷凝管及进出水管 |
E.在铁架台上放酒精灯,固定好铁圈,放上石棉网
F.固定好蒸馏烧瓶
G.加热
(2)以下是石油分馏的装置图,试指出有关仪器的名称:
A ;B 。
(3)图中有 处错误,
(4)分馏石油得到的各个馏分都是 (填“混合物”或“纯净物”)。
某化学研究性学习小组拟利用下列装置和药品进行四氯化锡的制备。供选择的药品:4.8gSn、浓HCl、稀HCl、浓H2SO4、MnO2、KMnO4、无水CaCl2、碱石灰。
仪器装置:
已知四氯化锡具有强的吸水性,水解生成锡的氧化物。
SnCl4和Sn的部分数据如下:
| 密度/(g·cm-3) |
熔点/℃ |
沸点/℃ |
|
| 四氯化锡 |
2.2 |
-33 |
114 |
| 金属锡 |
5.77 |
231 |
 |
请回答下列相关问题:
(1)实验时装置的正确连接顺序为A  ____
____ _____
_____ _____
_____ _____
_____

(2)仪器G的名称是_______实验时,冷却水的流向是从_________进入(填符号)
(3)A中反应的离子方程式 ;
(4)F中盛装的化学试剂是_________;作用是 、 。写出SnCl4水解的化学方程式
(5)实验完毕后,E装置质量增加9.4g,SnCl4的产率是
在平板电视显示屏生产过程中产生的废玻璃粉末中含有二氧化铈(CeO2).
(1)在空气中煅烧Ce(OH)CO3可制备CeO2,该反应的化学方程式
(2)已知在一定条件下,电解熔融状态的CeO2可制备Ce,写出阴极的电极反应式 ;
(3)某课题组以上述废玻璃粉末(含有SiO2、Fe2O3、CeO2以及其他少量不溶于稀酸的物质)为原料,设计如图1流程对资源进行回收,得到Ce(OH)4和硫酸铁铵.
①得到滤渣B时,需要将其表面杂质洗涤干净.洗涤的操作是 .
②反应(1)的离子方程式为 .
③操作I的名称是
④如图2,氧化还原滴定法测定制得的Ce(OH)4产品的纯度.
该产品中Ce(OH)4的质量分数为 (保留小数点后两位).若滴定所用FeSO4溶液已在空气中露置了一段时间,则测得该Ce(OH)4产品的纯度 (“偏高”、“偏低”或“无影响”).
草酸钴用途广泛,可用于指示剂和催化剂的制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 完全沉淀的pH |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
(1)浸出过程中加入Na2SO3的目的是将_____________还原(填离子符号)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价。该反应的离子方程式为____________。
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是_________;使用萃取剂适宜的pH是______。
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)= 。
甲酸(HCOOH)是一种有刺激性气味的无色液体,有很强的腐蚀性。熔点8.4℃,沸点100.7℃,能与水、乙醇互溶,加热至160℃即分解成二氧化碳和氢气。
(1)实验室可用甲酸与浓硫酸共热制备一氧化碳:HCOOH H2O+CO↑,实验的部分装置如下图所示。制备时先加热浓硫酸至80℃~90℃,再逐滴滴入甲酸。
H2O+CO↑,实验的部分装置如下图所示。制备时先加热浓硫酸至80℃~90℃,再逐滴滴入甲酸。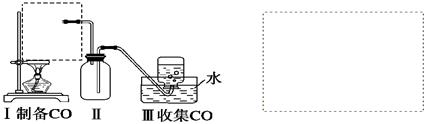
①从下图挑选所需的仪器,在虚线框中画出Ⅰ中所缺的气体发生装置(添加必要的塞子、玻璃管、胶皮管,固定装置不用画),并标明容器中的试剂。
②装置Ⅱ的作用是_____________________________________________。
(2)实验室可用甲酸制备甲酸铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸制得四水甲酸铜[Cu(HCOO)2·4H2O]晶体。相关的化学方程式是:
2CuSO4+4NaHCO3===Cu(OH)2·CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2·CuCO3+4HCOOH+5H2O===2Cu(HCOO)2·4H2O+CO2↑
实验步骤如下:
I.碱式碳酸铜的制备:
①步骤ⅰ是将一定量CuSO4·5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是___________。
②步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃~80℃,如果看到______(填写实验现象),说明温度过高。
II.甲酸铜的制备:
将Cu(OH)2·CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。在通风橱中蒸发滤液至原体积的1/3时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2—3次,晾干,得到产品。
a、“趁热过滤”中,必须“趁热”的原因是 。
b、用乙醇洗涤晶体的目的是 。
(1)写出MnO2与浓盐酸反应制Cl2的化学方程式 。
已知KMnO4与浓盐酸在常温下反应也可制得Cl2,某同学利用该原理,用右图所示的装置制备纯净、干燥的氯气,并做氯气与金属反应的实验。每个虚线框表示一个单元装置,其中有错误的是哪几处? (填序号)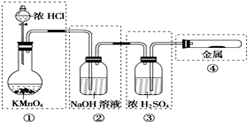
(2)化工厂生产盐酸的主要过程如图甲所示: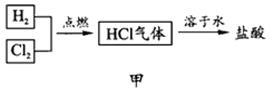
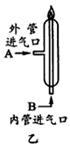
其中关键的一步为(如图乙所示)氯气和氢气在燃烧管口燃烧,生成HCl。由于氯气有毒,因此,通入气体的合理方式是:A处通入____, B处通入___,该过程涉及的操作有:①通氯气②通氢气③点燃正确的操作顺序为 (填序号)
(3)向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
① 写出并配平CCl4层由紫色变成无色的化学反应方程式(如果化学计量数是1,也请写上):__ +__
+__ +__
+__ ―→__
―→__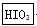 +__
+__
② 加碘盐中含碘量为20~50 mg·kg-1。制取加碘盐(含KIO3的食盐)1 000 kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况,保留2位小数)