某化学研究性学习小组拟利用下列装置和药品进行四氯化锡的制备。供选择的药品:4.8gSn、浓HCl、稀HCl、浓H2SO4、MnO2、KMnO4、无水CaCl2、碱石灰。
仪器装置:

已知四氯化锡具有强的吸水性,水解生成锡的氧化物。
SnCl4和Sn的部分数据如下:
| |
密度/(g·cm-3) |
熔点/℃ |
沸点/℃ |
| 四氯化锡 |
2.2 |
-33 |
114 |
| 金属锡 |
5.77 |
231 |
 |
请回答下列相关问题:
(1)实验时装置的正确连接顺序为A  ____
____ _____
_____ _____
_____ _____
_____

(2)仪器G的名称是_______实验时,冷却水的流向是从_________进入(填符号)
(3)A中反应的离子方程式 ;
(4)F中盛装的化学试剂是_________;作用是 、 。写出SnCl4水解的化学方程式
(5)实验完毕后,E装置质量增加9.4g,SnCl4的产率是
[有机化学基础]苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化 合物。已知:
合物。已知:
(1)写出反应类型:④__________________,A中含有官能团的名称。
(2)写出C的结构简式____________________,G的结构简式_____________________。
(3)写出反应B与氢氧化钠反应的化学方程式___________________________________________。
(4)写出反应②的化学方程式______________________________________________。
(5)写出反应⑧的化学方程式_______________________________________________。
(6)下列可检验阿司匹林样品中混有水杨酸的试剂是__________。
(a)三氯化铁溶液(b)碳酸氢钠溶液(c)石蕊试液
(7)保持官能团和位置不变,写出B的同分异构体有种
可逆反应N2+3H2 2NH3是工业上合成氨的重要反应。

图1 (图中表示生成1mol物质时的能量) 图2
(1)根据图1请写出合成氨的热化学方程式(热量用E1、E2或E3表示)
(2)图1中虚线部分是通过改变化学反应中的条件,请解释原因
(3)当反应达到平衡位置时不断改变条件(不改变N2、H2和NH3的量),图2表示反应速率与反应过程的关系,其中表示平衡混合物中NH3的含量最高的一段时间是
(4)在一定温度下,若将4a mol H2和2amol N2放入2L的密闭容器中,充分反应后测得N2的转化率为50%,则该反应的平衡常数为。若此时再向该容器中投入a mol H2、amol N2和2amol NH3,判断平衡移动的方向是(“正向移动”“ 逆向移动”或“不移动”)
(5)将上述实验中产生的NH3通入到0.04mol·L-1的FeCl3溶液中,要使溶液中Fe3+沉淀较完全(即Fe3+浓度降至原来的千分之一),则溶液的pH为(已知常温下,Fe(OH)3的溶度积常数Ksp=4×10-38)
已知:在实验中,常常利用高沸点酸制低沸点酸。以六水合氯化镁(MgCl2·6H2O)为原料制备无水氯化镁。已知MgCl2·6H2O晶体在空气中加热时,释放出部分结晶水,同时生成Mg(OH)Cl或MgO;在干燥HCl气流中加热,能制得无水MgCl2。
可选用药品:MgCl2·6H2O晶体、NaCl(s)、KClO3(s)、MnO2、浓H2SO4、浓盐酸、稀NaOH溶液。 仪器如图所示(装置可重复使用)。回答下列问题:
仪器如图所示(装置可重复使用)。回答下列问题: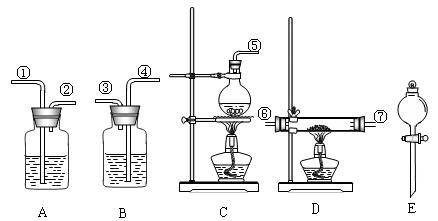
(1)组装氯化氢气体发生器,应选用的仪器(用编号A、B等填入)是,
有关的化学方程式是。
(2)按气流方向,其余装置的连接顺序(用数字①、②等填入)是:
()→()()→()()→()()
(3)各装置中应放的药品: B.______,D.______,E.______。
(4)B装置的作用是_________________。
(5)从实验安全角度考虑,上述所给药品和仪器设计的实验存在不足,请你提出修改建议:。
如右图所示,B中盛装的是一种固体物质。当A中的溶液滴入B内反应一段时间后,所得产物经装置C后可得到纯净的气体X,每个X分子中含有10个电子。D中盛装的是黑色粉末,当X气体通过D时,黑色粉末逐渐变成红色,最后从E装置中出来的气体是一种纯净的单质Y,Y在标准状况下的密度为1.25g/L。装置中A、B、C、D、E中的药品只能从下列所给试剂a~p中选择,图中某些夹持仪器未画出。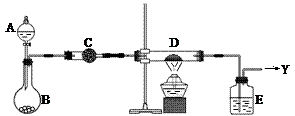
a.浓硫酸 b.浓硝酸 c.稀硝酸 d.浓盐酸 e.稀硫酸 f.浓氨水
g.铜片 h.锌片 i.碱石灰 j.硫酸铜 k.生石灰 l.硝酸铵晶体
m.固体烧碱 n.稀NaOH溶液 o.CuO p.MnO2
回答下列问题:
⑴C装置内的药品是(用a~p中的字母表示),其作用是。
⑵A中溶液和B中固体的所有可能的组合共有种。
⑶纯净气体X通过D时,发生反应的化学方程式是,反应中若转移电子的物质的量为1.2mol,则D装置中黑色固体共失重g。
⑷E中的药品是(用a~p中的字母表示),其作用是。
有机物A由C、H、O、Cl四种元素组成,其相对分子质量为198.5,Cl在侧链上。当A与Cl2分别在Fe作催化剂和光照条件下以物质的量之比为1:1反应时,分别是苯环上一氯取代有两种和侧链上一氯取代有一种;A与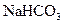 溶液反应时有气体放出。A经下列反应可逐步生成B~G。
溶液反应时有气体放出。A经下列反应可逐步生成B~G。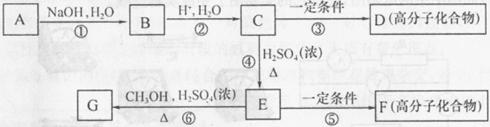
(1)A的分子式为________;D的结构简式为_________;
(2)上述反应中属于取代反应的是_________ (填编号);
(3)C中含氧官能团的名称为_______、________;
(4)E的同分异构体中,满足①苯环上只有一个侧链,且侧链上含有一个一CH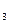 ;②能发生银镜反应;③属于酯类。则其结构简式为(写3种):
;②能发生银镜反应;③属于酯类。则其结构简式为(写3种):
________、________、________;
( 5)写化学方程式(有机物写结构简式):
5)写化学方程式(有机物写结构简式):
A与NaOH的醇溶液共热:______; E在一定条件下生成F:______。