将一小块银白色的金属钠放置在空气中会发生下列变化:
钠(
) 钠的氧化物
钠的氧化物 氢氧化钠溶液
氢氧化钠溶液 白色固体
白色固体
【提出问题】:常温下钠与氧气反应,产物有哪些?
【查阅资料】:钠的氧化物,除氧化钠(
)外还有过氧化钠(
),氧化钠与过氧化钠都能与水发生反应,方程式如下:
;
【作出猜想】:常温下钠与氧气反应的产物.
猜想1:
,
猜想2:
,
猜想3:
【实验探究一】:
| 实验操作 |
实验现象 |
实验结论 |
| 取少量钠的氧化物加入足量蒸馏水 |
猜想1正确 |
【继续探究】:钠在空气中放置一段时间得到白色固体的成分
【作出猜想】
猜想一:
猜想二:
和
【实验探究二】:
| 实验操作 |
实验现象 |
实验结论 |
| 1.取少量白色固体加入足量 |
产生白色沉淀 |
白色固体成分 和 |
| 2.过滤、取少量滤液加入 |
【实验反思】
(1)类比氧化铜与盐酸的反应,写出氧化钠与盐酸反应的化学方程式 。
(2)过氧化钠也能与盐酸反应,方程式为:
,X的化学式为 。
(3)能与酸反应只生成盐和水的氧化物称为碱性氧化物,请判断
碱性氧化物(填"是"或"不是")。
某校化学兴趣小组参观碱式碳酸镁的生产后,知道了以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁[xMgCO3·yMg(OH)2·zH2O]的主要流程如下: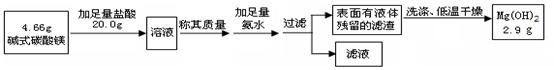
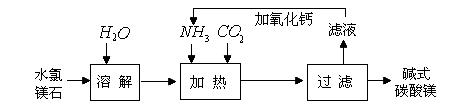
【问题讨论】
(1)上述流程中滤液的主要溶质(写化学式),检验其中阳离子要用的试剂有(填序号)。
A. 氧化钙 B. 稀盐酸 C. 紫色石蕊试液 D. 硫酸钠溶液
(2)上述流程中NH3被循环使用,流程中生成NH3的化学方程式为。
(3)流程中“加热” 这一环节每生成l个分子xMgCO3·yMg(OH)2·zH2O需消耗氨的分子数为(用代数式)。
(4)判断碱式碳酸镁是否洗涤干净,可以采取向最后的洗出液中滴加(填序号),然后观察现象判断。
A. 盐酸和氯化钡的混合液 B. 硝酸和硝酸银的混合液 C.碳酸钠溶液 D.稀盐酸
【组成探究一】
(5)已知高温煅烧碱式碳酸镁得到MgO,用下列装置设计实验测定碱式碳酸镁的组成,装置连接从左到右依次为A→→→D。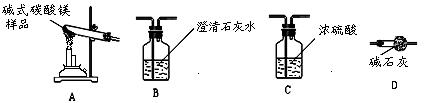
(6)取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g、CO21.76g,通过计算确定碱式碳酸镁的化学式为。。
计算过程(3分)
【组成探究二】
(7)有同学对用盐酸有异议,认为用硫酸更好。你的看法是(填序号);
A.同意 B. 不同意 C. 不确定
你的理由是 。
(8)称得的溶液质量为g [提示:可用⑹中数据]
【组成探究三】
更为精确的测量碱式碳酸镁受热分解过程中时间与剩余固体质量,作出如下的坐标图
(9)试回答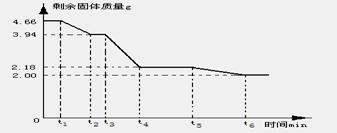
①加热时,该晶体开始发生化学变化的时刻是(填“t1”、“t3”或“t5”)。
②t4~t5时间段固体为(写化学式)和MgO的混和物。
③t2~t3时间段固体的化学式为(用含x、y的化学式也算对)。
在发明电解法以前,人们常用贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原料制取烧碱。某小组同学按下图所示流程进行实验,请你参与探究并回答相关问题。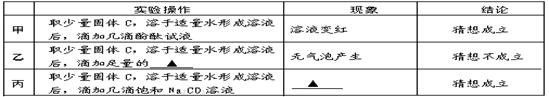
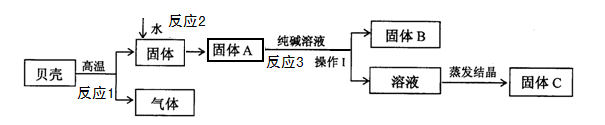
(1)反应1的化学方程式是
(2)反应3的化学方程式是;
(3)操作I中用到的玻璃仪器有烧杯、、玻璃棒;
(4)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是;
【问题与发现】该小组同学所得固体C一定是纯净的NaOH吗?
【猜想与假设】根据反应原理,甲、乙、丙三位同学提出以下猜想:
甲:纯净的NaOH
乙:NaOH和Na2CO3的混合物
丙:NaOH和的混合物
【探究与验证】甲、乙、丙三位同学分别设计下列方案,对自己的猜想进行验证。实验操作、现象和结论如下表,请参与他们的探究并完成所缺内容。
【反思与评价】 同学们认真研究实验流程,讨论后一致认为乙、丙两同学的方案、现象和推理均正确,请你根据实验流程对甲同学设计方案进行评价:。
通过对化学的学习,你已掌握了实验室制取气体的有关规律,请结合下图回答有关问题:
(1)图中标有a的仪器名称是。
(2)实验室用高锰酸钾制取氧气,反应的化学方程式为,可选择的收集装置是D或(填字母,下同)。
(3)实验室用锌和稀硫酸制取氢气,应选择的发生装置是,反应的化学方程式为。
(4)氨气是一种无色、有刺激性气味、极易溶于水的气体,可用于制氮肥、硝酸、药物和染料等。
①若实验室用加热氯化铵和熟石灰的固体混合物的方法制取氨气,则实验室制取并收集氨气应选择的装置组合是。
②工业上用氮气和氢气合成氨气(反应的化学方程式: ;已知:同温同压下气体的体积比等于气体的分子数之比)。实验室模拟合成氨气的流程如下:
;已知:同温同压下气体的体积比等于气体的分子数之比)。实验室模拟合成氨气的流程如下:
流程中“气体的混合”是在F装置中进行的,F装置的作用有三个:一是将氮气和氢气干燥;二是使氮气和氢气充分混合;三是,从而提高氮气和氢气的利用率。
某校化学兴趣小组将一根光亮的细铁丝均分为三份,绕成相同的形状用下图所示装置对铁生锈的条件进行了探究。
请回答:
(1)A中反应的化学方程式为;
(2)B中生石灰的作用是除去氧气中的水蒸气,其反应的化学方程式为;
(3)4分钟后观察:C处铁丝依然光亮,D处铁丝表面灰暗,E中铁丝依然光亮。说明铁生锈主要与、有关。
(4)D、E处实验现象对比说明:决定铁生锈快慢的一个重要因素是。
根据下列装置图,回答有关问题:
(1)图中标号仪器的名称:①,②。
(2)利用上图中A、D装置的组合可以制取某种气体,实验室制取该气体的化学方程式是
,验满方法是。
(3)实验室通常利用上图中装置B与的组合制取二氧化碳(选填字母),该反应的化学方程式为。若用C装置代替B装置进行实验,优点为。
①为了得到纯净、干燥的二氧化碳气体,除杂装置(如右图)的导管按气流方向连接顺序是(选填字母)。
A.a→b→d→c B.b→a→c→d
C.d→c→a→b D.c→d→b→a
②常用澄清石灰水检验二氧化碳的存在,该反应的化学方程式为;