(5+4分)某淡黄色的颗粒状固体,其化学性质比较活泼,在通常状况下能跟许多物质发生化学反应。例如:它与CO2反应时,生成了Na2CO3和O2;它与稀盐酸反应时,生成了NaCl、H2O和O2。上课时,老师做了如下实验:(6+4分)
a.取少量的淡黄色的颗粒状固体投入到盛有少量水的试管中,可观察到产生了一种无色无味的气体;
b.再向试管中滴加几滴酚酞试液,可观察到烧杯中溶液变红(酚酞遇碱溶液变红色)。
根据以上信息,回答下列问题:
(1)淡黄色的颗粒状固体中一定含有 元素。
你做出这个判断的理由是 。
(2)实验a中产生的气体,可用 法收集。
(3)同学们对实验a中产生的气体的组成看法不一,提出了以下几种假设:①该气体是CO;②该气体是H2。请你推测该气体还可能是 (写化学式)
(4)设计一个实验,证明你在(3)中的推测(写出简要操作步骤,反应现象和结论)。
(本题对奖励4分,化学试卷总分不超过60分)
| 操作步骤 |
|
| 反应现象 |
|
| 结论 |
|
(1)用如图1所示装置进行实验,探究物质溶解是吸热还是放热,仪器a的名称是.若出现导管中红墨水液面左管降低右管升高,则试管中加入的物质可以是(填序号).
| A. | 固体; | B. | 浓硫酸; | C. | 固体; | D. | 固体. |
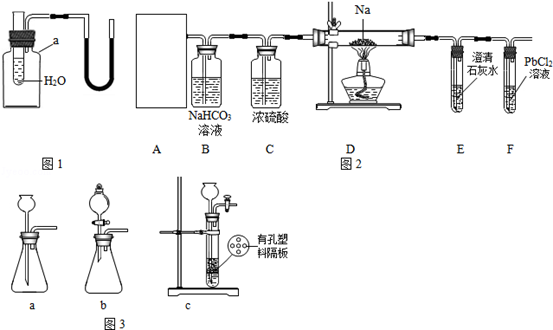
(2)实验室用氯酸钾和二氧化锰制氧气,反应的化学方程式是,反应中二氧化锰的作用是.要从充分反应后的剩余固体中分离出氯化钾晶体,需要进行的实验操作有.
(3)某化学学习小组的同学在网上查资料时得知,金属钠着火不能用
灭火.他们想知道,
与
反应究寓会生成什么物质呢?
【提出猜想】
Ⅰ.
Ⅱ.
III.
溶液检验:
【实验操究】该小组成员设计了如图2所示实验:
【分析讨论】
①装置A用盐酸与石灰石反应制备
,反应的化学方程式为.为使制备
的反应能随开随用,随关随停,所选装置应是图3中的.
②装置B的作用是除去二氧化碳气体中混有的HCl气体,反应的化学方程式是;装置C的作用是.
③经检查整套装置气密性良好,装好药品使A中产生
,必须待装置E中出现现象时再点燃酒精灯,其目的是.
【实验结论】
实验观察到的现象是:装置D中的硬质玻璃管内残留白色固体,装置F中产生黑色沉淀,则猜想是正确的.
某天化学兴趣小组听老师讲:"浓硫酸加衣服等于洞洞眼眼,还有刺激性气味产生".兴趣小组结合浓硫酸的性质思考,难道浓硫酸能与碳单质反应?若反应,会生成什么呢?
[查阅资料]:
①
能使澄清石灰水变浑浊
;
②
能使品红溶液褪色,用于检验
存在;
③
能与溴水反应而被吸收
.
[提出猜想]:从物质组成元素看,可能生成
、
、
、
气体及
;
[实验步骤]:实验小组设计了如下步骤: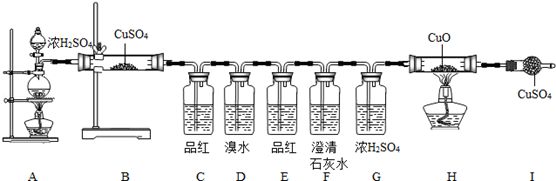
(1)按上述图示安装好仪器;
(2)检查气密性;
(3)加入对应药品,并将浓
放入烧杯中;
(4)加热
,加热
;
(5)停止加热.
[实验分析]:
(1)
处,固体由白色变蓝色,说明有H2O生成;
(2)
处,品红溶液褪色,说明有(填化学式)生成;
(3)
处,品红溶液不褪色,说明(填化学式)已被除尽;
(4)
处,澄清石灰水变浑浊,则产生浑浊的化学方程式为;
(5)
、
处无现象,说明无
、
生成.
[实验结论]:
(1)气体中有
和生成,无
、
生成;
(2)浓硫酸能与碳单质反应,其化学方程式为.
日常生活中使用的塑料袋,有的是用聚乙烯制成的,有的是用聚氯乙烯制成的.小凤对包装食品的塑料袋进行探究,以验证其成分.



A B C D
作出猜想:①该塑料袋是用聚乙烯制成的②该塑料袋是用聚氯乙烯制成的;
查阅资料:聚乙烯燃烧生成二氧化碳和水;聚氯乙烯燃烧生成二氧化碳、水和氯化氢;无水硫酸铜是白色粉末,遇水变为蓝色.
实验探究:小凤将装置按A、B、C、D顺序连接好后,进行实验.在实验过程中,B、D产生明显现象,C无明显现象,说明塑料袋没有气体生成(填化学式).B装置的作用是;D瓶中发生反应的化学方程式是.
实验结论:通过实验证明,猜想是正确的.
交流反思:①从化学角度分析,大量使用塑料制品会导致.
②连接实验仪器时,能否(填"能"或"不能")将B、C位置进行交换,理由是.
草酸亚铁晶体(
)是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料。某化学兴趣小组设计实验验证草酸亚铁热分解的气体产物,并用热重法(TG)确定其分解后固体产物的组成。探究过程如下:
【查阅资料】
1. 草酸亚铁晶体热分解的气体产物是
、
、
2. 白色的无水
遇水蒸气会变成蓝色
【实验设计】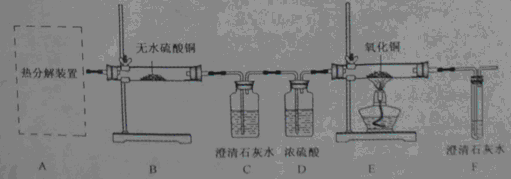
(1)从环保角度考虑,该套实验装置的明显缺陷是。
(2)可选择以下实验装置中的(选填:"甲"或"乙")作为虚线中的"热分解装置"。
【问题讨论】
(3)D中浓硫酸的作用是,实验过程中观察到B中白色无水
变成蓝色,C中澄清石灰水变浑浊,E中(填实验现象),则可证明草酸亚铁晶体热分解的气体产物是
、
、
。
(4)该兴趣小组进行上述实验时,先点燃热分解装置中的酒精灯,一段时间后再点燃E处的酒精灯,原因是。
(5)若通过F装置中澄清石灰水变浑浊来证明草酸亚铁晶体热分解的气体产物中有
,则需在C和D装置之间增加盛有(填物质的名称或化学式)溶液的洗气瓶。
【数据分析】
(6)称取3.60g草酸亚铁晶体(
,相对分子质量180)用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如下图所示,请分析该图回答下列问题: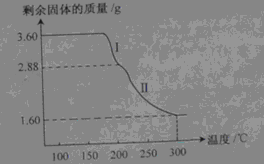
①过程Ⅰ发生反应的化学方程式为。
②3000℃时剩余固体只有一种且是铁的氧化物,试通过计算确定该氧化物的化学式或名称。(请写出计算过程)
某研究性学习小组在学习金属铁的知识后,为了解铜及其常见化合物的性质,运用类比的思想提出了如下问题,并进行探究。请帮助完成下列有关研究并填写有关空白。
(1)【提出问题】
①铁能与稀硫酸反应产生氢气,铜能吗?铜与浓硫酸会发生反应吗?
②铁在潮湿的空气中易生锈,铜"生锈"需要什么条件?
③氧化铁能够被一氧化碳还原,氧化铜可以吗?氧化铜能直接转化为氢氧化铜吗?氧化铜还有哪些性质?
④有哪些途径可以由铜逐步转变为氢氧化铜?
(2)【查阅资料与问题解决】
①铜不能与稀硫酸发生置换反应,是因为在金属活动性顺序表中,铜排在之后。 铜能与浓硫酸发生反应,其反应方程式为:
↑此反应中化合价升高的元素是。
②铜在潮湿的空气中也能"生锈"形成铜绿,铜绿的主要成分为
。由此可以推测:铜"生锈"过程中,参与反应的物质有铜、氧气、水和。
③氧化铜可以在加热的条件下被一氧化碳等还原成铜,其与一氧化碳反应的化学方程式为;氧化铜不能与水反应生成氢氧化铜,但能与硫酸、盐酸等发生复分解反应形成相应的铜盐;在高温下,氧化铜能分解成砖红色的氧化亚铜(
)和氧气,反应的化学方程式为。
④由铜转化为氢氧化铜,从化学反应的原理看,可以是流程I:
也可以是流程II:
与流程I相比,流程Ⅱ的优点是和。 还可以有更多的流程。若流程Ⅲ与流程I相比,也是两步反应,但第一步与铜反应的试剂不同,则流程Ⅲ中第一步反应的化学方程式为。