实验室常用亚硫酸钠(
)固体与稀硫酸在常温下反应制取二氧化硫气体。我们知道二氧化碳能与水反应生成碳酸,那么二氧化硫与水反应是否也能生成酸呢?某实验小组对此进行探究。
【作出猜想】
【查阅资料】① 二氧化硫不与浓硫酸反应;②酸能使湿润的蓝色石蕊试纸变红;
③二氧化硫有毒,能与碱溶液反应生成盐和水。
【设计实验】一、验证水能否使蓝色石蕊试纸变色;
二、验证二氧化硫气体能否使干燥的蓝色石蕊试纸变色;
三、验证二氧化硫气体能否使湿润的蓝色石蕊试纸变红。
实验装置和药品如图:

(1)写出带标号仪器的名称:
(2)实验过程中装置
内石蕊试纸的颜色始终没有变化,这说明
(3)装置
中胶头滴管中的蒸馏水在二氧化硫气体生成之前滴到蓝色石蕊试纸上,未见试纸颜色发生变化,当有二氧化硫气体通过时发现湿润的蓝色石蕊试纸变红。此现象说明
(4)装置
的作用是
【实验结论】根据以上实验操作和现象,原猜想
【反思与拓展】是不是所有的非金属氧化物都能与
反应,生成相应的酸?
某化学兴趣小组的同学对能制氧气的呼吸面具进行研究。
[查阅资料]
(1)呼吸面具中制取氧气的主要原料是固体过氧化钠(Na2O2)。过氧化钠分别能和二氧化碳、水反应,都生成氧气,反应的化学方程式为:
①2Na2O2+ 2H2O ═ 4NaOH + O2↑
②2Na2O2+2CO2 ═ 2Na2CO3+ O2
(2)氯化钙溶液呈中性;碳酸钠溶液呈碱性;氯化钙溶液与碳酸钠溶液混合后发生如下反应:
Na2CO3+ CaCl2 ═ CaCO3↓ + 2NaCl。
同学们对用过一段时间后的面具中的固体成分产生兴趣。
[猜想与假设]
固体可能为:①Na2CO3;②NaOH和Na2CO3;③Na2O2和Na2CO3;④。
为了确定用过一段时间后呼吸面具中的成分,该小组的同学在老师的指导下进行了以下的探究。
[进行实验]
实验Ⅰ:取少量固体放入试管中,加足量水,看到,证明固体中有Na2O2。
实验Ⅱ:取少量固体放入试管中,滴加足量的稀盐酸,产生大量气泡,则证明固体中含有Na2CO3。
实验Ⅲ:取少量固体放入试管中,加足量水,再滴加足量的氯化钙溶液后,过滤。向滤液中加入酚酞试液,若溶液变成,则证明固体中含有NaOH。
[反思与评价]
通过上述实验,有些同学认为其中有些不妥的结论。
(1)有些同学认为通过实验Ⅱ并不能确定固体中含有Na2CO3。如何改进此实验?。
(2)还有些同学认为通过实验Ⅲ也不能证明固体中一定含有NaOH。其原因是:。
实验小组研究碳酸钠和碳酸氢钠的性质。
实验一:甲、乙、丙三位同学分别用溶质质量分数为5%的NaHCO3溶液和Na2CO3溶液进行了如下实验。
| 实验内容 |
NaHCO3溶液 |
Na2CO3溶液 |
| (1)加入无色酚酞溶液 |
溶液变红 |
溶液变红 |
| (2)加入澄清石灰水 |
产生白色沉淀 |
现象Ⅰ |
| (3)加入5%的CaCl2溶液 |
产生白色沉淀、有气泡产生 |
产生白色沉淀 |
| (4)加入稀盐酸 |
现象Ⅱ |
有气泡产生 |
| (5)加热溶液,并用导管与澄清石灰水连接 |
石灰水变浑浊 |
石灰水无明显变化 |
(1)表中的现象Ⅰ为;用化学方程式表示现象Ⅱ的原因。
(2)若要鉴别实验中用到的NaHCO3和Na2CO3两种溶液,实验一中提供了种方法。
实验二:甲、乙、丙三位同学分别将各自实验一中NaHCO3溶液与澄清石灰水反应后的物质进行过滤,对滤液中的溶质成分进行了如下探究。
【查阅资料】
(1)氯化钙溶液显中性,与氢氧化钠溶液不反应。
(2)两种溶液的取用量不同,滤液中溶质的组成情况可能有:①NaOH;②Na2CO3;③NaOH和Ca(OH)2;④Na2CO3和NaHCO3;⑤Na2CO3和NaOH。
【进行实验】
| 实验操作 |
实验现象 |
实验结论 |
|
| 甲同学 |
取少量滤液于试管中,滴加足量的稀盐酸 |
有气泡产生 |
滤液中的溶质一定含有Na2CO3 |
| 乙同学 |
取少量滤液于试管中,向其中通入少量CO2 |
产生白色沉淀 |
则滤液中的溶质是 |
| 丙同学 |
取少量滤液于试管中,塞紧胶塞,并用导管与澄清石灰水连接,加热 |
澄清石灰水变浑浊 |
则滤液中的溶质是Na2CO3和NaHCO3 |
【反思与评价】
(1)根据丙同学的结论,NaHCO3溶液与澄清石灰水反应的化学方程式是。
(2)甲同学进一步实验,确定了滤液中的溶质是Na2CO3和NaOH。其实验方案是。
化学小组同学取一定量碳酸钙固体高温煅烧一段时间,冷却后,对剩余固体成分进行如下探究。
【提出问题】剩余固体成分是什么?
【查阅资料】工业上通常采用高温煅烧石灰石的方法制生石灰,化学方程式为:CaCO3高温CaO+CO2↑。
【猜想与假设】剩余固体成分:
I.全部是氧化钙 Ⅱ.Ⅲ.全部是碳酸钙
在老师指导下,小组同学设计如下实验,探究上述猜想是否成立。
【进行实验】
①甲同学取一定量的剩余固体于试管中,加入一定量的水振荡,有白色不溶物。甲同学据此认为试管中的固体为碳酸钙,即猜想Ⅲ成立。乙同学认为上述实验不足以证明猜想Ⅲ成立,其理由是。
②乙同学取一定量的剩余固体于试管中,加入一定量的水,触摸试管外壁感觉发热,继续向试管中加入几滴稀盐酸,没有气泡产生。乙同学据此认为试管中的固体只有氧化钙,即猜想I成立。丙同学认为乙的实验不足以证明猜想I成立,理由是。
③丙同学利用水、无色酚酞溶液和稀盐酸证明了猜想Ⅱ成立,请完成实验报告。
| 实验步骤 |
实验现象 |
实验结论 |
| 猜想Ⅱ成立 |
【反思拓展】
工业制生石灰的过程中同时得到副产品二氧化碳。下列用途是利用二氧化碳化学性质的是。
A.气体肥料B.制干冰 C.制纯碱 D.制碳酸饮料
化学课上老师向盛有NaOH溶液的试管中滴入2—3滴无色酚酞试液,振荡溶液呈红色。
提出问题:是什么微粒使无色酚酞变红?
查阅资料:NaOH溶液中主要存在H2O、OH-、Na+三种粒子。
猜想:①水分子使无色酚酞变红;
②Na+使无色酚酞变红;
③______使无色酚酞变红。
实验验证:
| 实验操作 |
现象 |
结论 |
| 实验一:分别向盛有NaOH溶液和蒸馏水的试管中滴入2—3滴无色酚酞试液 |
NaOH溶液中滴入酚酞后变红,蒸馏水中滴入酚酞后无现象。 |
猜想_______不成立。 |
| 实验二:_______________ |
________________________。 |
猜想②不成立。 |
| 实验三:分别向盛有NaOH溶液和石灰水的试管中滴入2—3滴无色酚酞试液 |
两支试管中滴入酚酞后均____。 |
猜想③成立。 |
在学习碱的化学性质时,某小组同学进行了如图所示的实验。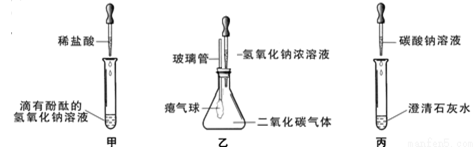
Ⅰ.探究碱的化学性质
①实验甲,随着稀盐酸的不断滴入,观察到溶液由红色变为无色;
②实验乙滴加氢氧化钠溶液后,观察到的气球变鼓;
③实验丙观察到试管内有白色沉淀产生,发生反应的化学方程式为(1)。
Ⅱ.探究废液成分
实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,由此产生疑问。
【提出问题】废液中含有哪些物质?
【查阅资料】BaCl2溶液呈中性且Na2CO3 +BaCl2 ==BaCO3↓ +2NaCl
【讨论交流】
①废液中一定含有的物质:碳酸钙、指示剂、水和(2);
②还含有能使废液呈碱性的物质,同学们有如下猜想:
猜想1:碳酸钠;
猜想2:氢氧化钠;
猜想3:氢氧化钠和碳酸钠;
猜想4:氢氧化钠和氢氧化钙。
【查阅资料】BaCl2溶液呈中性,Na2CO3+BaCl2=BaCO3↓+2NaCl
【实验设计】
同学们认为需要先验证猜想4是否成立,所需要的试剂是(3)。
若猜想4不成立,则需要进行后续实验,请你完成表格。
实验操作预计现象预计结论
_______(4)__________ _________(5)__________猜想1正确
若没有白色沉淀,溶液呈红色猜想2正确
_________(6)____________猜想3正确
【进行实验】同学们进行实验,通过观察实验现象,得出了猜想2成立。
【反思拓展】分析化学反应后所得物质成分时,除考虑生成物外还需考虑反应物是否有剩余。