高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下: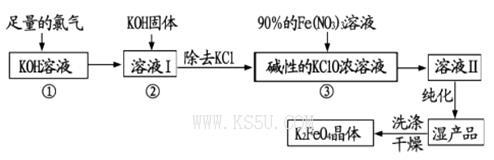
请同答下列问题:
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式_______ 。
(2)在溶液I中加入KOH固体的目的是______(填编号)。
| A.为下一步反应提供碱性的环境 |
| B.使KClO3转化为KClO |
| C.与溶液I中过量的Cl2继续反应,生成更多的KClO |
| D.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3,KCl,则反应③中发生的离子反应方程式为_______。每制得59.4克K2FeO4,理论上消耗氧化剂的物质的量为____ mol。
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:___ FeO42-+___ H2O="___" Fe(OH)3(胶体)+_____O2↑+___OH-。
氮是地球上极为丰富的元素。
(1)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为。
(2)N≡N的键能为942 kJ·mol-1,N—N单键的键能为247 kJ·mol-1,计算说明N2中的键比键稳定。(填“σ”或“π”)
(3)(CH3)3NH+和AlCl4-可形成离子液体。离子液体由阴阳离子组成,熔点低于100 ℃,其挥发性一般比有机溶剂(填“大”或“小”),可用作(填代号)。
a.助燃剂 b.“绿色”溶剂 c.复合材料 d.绝热材料
(4)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的元素符号是,与同一个N3-相连的X+有个。
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。
根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为_______。
(2)上述反应中的氧化剂是_______,反应产生的气体可用_______吸收。
(3)As2S3和HNO3有如下反应:As2S3 + 10H+ + 10NO3-→2H3AsO4 + 3S+ 10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为_______。若将该反应设计成原电池,则NO2应该在____(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量____(选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5 mol d.无法确定
化合物A(C11H8O4)在氢氧化钠溶液中加热反应后再酸化可得到化合物B和C。回答下列问题:
A.B的分子式为C2H4O2,分子中只有一个官能团。则B的结构简式是________,B与乙醇在浓硫酸催化下加热反应生成D,该反应的化学方程式是________________________,该反应的类型是________;写出两种能发生银镜反应的B的同分异构体的结构简式________________________。
B.C是芳香族化合物,相对分子质量为180,其碳的质量分数为60.0%,氢的质量分数为4.4%,其余为氧,则C的分子式是________。
(3)已知C的芳环上有三个取代基,其中一个取代基无支链,且还有能使溴的四氯化碳溶液退色的官能团及能与碳酸氢钠溶液反应放出气体的官能团,则该取代基上的官能团名称是。另外两个取代基相同,分别位于该取代基的邻位和对位,则C的结构简式是。
已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色。各物质的转化关系如下图(部分反应物已略去)。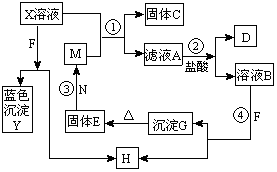
请回答下列问题:(1)E的化学式为。
(2) 将M丝插入盛有X溶液的试管中,反应一段时间后的现象是。
(3) 反应②的离子方程式为。
(4)在反应①②③④中属于置换反应的是。
(10分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g) CH3OH(g)ΔH1
CH3OH(g)ΔH1
反应II:CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH2
CH3OH(g)+H2O(g)ΔH2
①上述反应符合“原子经济”原则的是(填“I”或“Ⅱ”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH10(填“>”、“=”或“<”)。
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为。
(2)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
①该电池正极的电极反应为。
②工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为。