将一定质量由Cu和CuO组成的固体粉末加入到100 mL 11 mol/L的浓HNO3中,充分反应后,固体溶解完全,收集到NO、NO2混合气体6.72 L(标准状况)。若将该混合气体与2.24 L O2(标准状况)混合并通入到足量水中,恰好生成HNO3。
(1)NO的体积是 L,NO2的体积是 L(标准状况)。
(2)固体粉末中Cu单质的质量是 g。
(3)向浓HNO3反应后的溶液中加入4 mol/L的NaOH溶液,当Cu2+恰好沉淀完时,需要NaOH溶液的体积是 L。
(8分)工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72—氧化成CO2和H2O,反应式为:
CH3OH+Cr2O72—+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72—可用Fe2+与之完全反应:
_____Cr2O72—+_____Fe2++_____H+ —_____Cr3++______Fe3++______H2O
现有0.12 g工业甲醇,在H2SO4溶液中与25 mL 0.2 mol·L-1K2Cr2O7溶液反应,
多余的K2Cr2O7再用1 mol·L—1FeSO4与其反应,结果用去FeSO4溶液9.6 mL。
(1)配平第②步中离子方程式。
(2)计算工业甲醇的质量分数。
将35.8gNa2CO3和NaHCO3的固体混合物溶于足量水中,向其中逐滴加入1mol·L-1的盐酸至不再产生气体为止,测得共产生CO28.96L(标准状况)(气体溶解忽略不计)。回答:
⑴原混合物中Na2CO3为 _______________g
⑵若以滴加盐酸的体积为V(mL),产生气体的物质的量为n(mol),建立n=f(V)的函数关系,将V在不同取值时,n=f(V)的关系式填入下表并作图
| V值 |
n=f(V) |

有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体多少升?(设反应中HNO3被还原成NO)
(10分)有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
(1)甲取样品①,反应后的溶液中铁只以Fe3+离子的形式存在,则样品①的质量为g。
(2)乙取样品②,反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量(设为ag)范围是。
(3)丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应过程中溶液里Fe3+、Fe2+、NO3—三种离子中的两种离子的物质的量的变化曲线如下图所示,则该曲线表示的是
物质的量变化的曲线,请你在此图中再画出另外种离子的物质的量的变化曲线。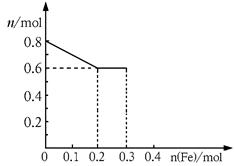
(8分)将一定量的氧化铜加入到100.Og质量分数为19.6%的硫酸溶液中,完全溶解后溶液显蓝色,再加人19.6g铁粉充分反应后,经过滤、干燥得到的固体仍为19.6g。
(1)通过计算说明干燥后的固体是什么物质?
(2)求原氧化铜的质量。