草酸(H2C2O4)是生物体的一种代谢产物。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。已知草酸晶体(H2C2O4•2H2O)无色,易溶于水,熔点为101℃,受热脱水、升华,170℃以上分解。试回答下列问题:
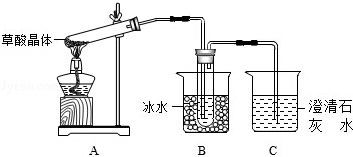
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,装置C中可观察到有气泡冒出且澄清石灰水变浑浊,由此可知草酸晶体分解的产物中有 。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。

①乙组同学的实验装置中,依次连接的合理顺序为:
A→B→( )→D→G→( )→D→I
装置H反应管中盛有的物质是__________________(写化学式)。
②能证明草酸晶体分解产物中有CO的现象是__________,__________,第二个D装置中澄清石灰水变浑浊。
聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:
(1)验证固体W焙烧后产生的气体含有SO2的方法是________________。
(2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器接口,顺序为a→________→________→________→________→f。
装置A中发生反应的化学方程式为___________________。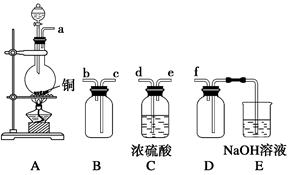
(3)制备绿矾时,向溶液X中加入过量________,充分反应后,经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。过滤所需的玻璃仪器有________________。
(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准 溶液,用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
(5)溶液Z的pH影响聚铁中铁的质量分数。若溶液Z的pH偏小,将导致聚铁中铁的质量分数________(填“偏大”、“偏小”或“无影响”)。
某研究性学习小组对铝热反应实验展开研究。现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
| 熔点/℃ |
660 |
2054 |
1535 |
1462 |
| 沸点/℃ |
2467 |
2980 |
2750 |
- |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________________(填“合理”或“不合理)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是______________,反应的离子方程式为_________________________________。
(3)实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入8mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。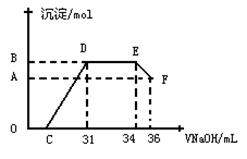
试回答下列问题:
(1)写出图中各段 反应的离子方程式:O~C___________________E~F段______________;
(2)上述现象说明溶液中_________________结合OH-的能力比_______强(填离子符号)。
(3) B与A的差值为_________mol。B点对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为___________mL
(4)为测定熔融物各成分的质量分数,有下列几种方案,其中正确的是______________。比较好的是_________。
A.熔融物的质量(m)和用NaOH处理该熔融物后溶液增加的质量(n);
B.熔融物用NaOH处理该熔融物后增加的质量(n)与产生的标准状况下气体的体积(V);
C.熔融物的质量(m)和用稀硫酸处理该熔融物后产生的标准状况下气体的体积(V);
有A、B、C、D、E、F、G七种短周期元素,它们的原子序数依次增大,已知:A的原子中没有中子,B的一种单质是硬度最大的物质,D原子的最外层电子数是其电子层数的三倍,E与A同一主族,其最高价氧化物对应的水化物是水溶液在短周期元素中碱性最强,G是地壳中含量最多的金属元素。按下列要求填空:
(1)B的最高价氧化物的结构式是_______;其等电子体的化学式是___________。 (任写一种)
(2)写出F的单质置换B的单质反应的方程式: 。
(3)C与F形成化合物的电子式是___________;与一定体积一定浓度的盐酸恰好完全反应产生两种盐,反应的化学方程式是: 。产生的两种盐的水溶液显酸性,原因是____________(用离子方程式表示),在该溶液中离子浓度的大小关系是___________。
(4)写出由A、B组成的既含极性键又含非极性键且相对分子质量小的物质的实验室制法的反应方程式: 。在实验室用电石制取该气体时通常有一种刺激性气味产生,原因是_____________,除去杂质的方法是________________。
(5)元素G的氢氧化物制取方法是___________(用化学方程式表示),含有G的硫酸盐常用于水处理,原因是__________________(用离子方程式表示).
(6)A与B、C形成的简单化合物的沸点的高低比较是前者________(填>、<、=)后者,原因是________,在A与C形成的化合物的水溶液则含有的微粒种类是____种(填数目)。
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。已知氯化铁是一种重要的化工原料,无水氯化铁遇潮湿空气极易吸水生成FeCl3·nH2O。
(1)某学习小组用下图装置在实验室制备无水氯化铁,请你一起参与该小组的活动。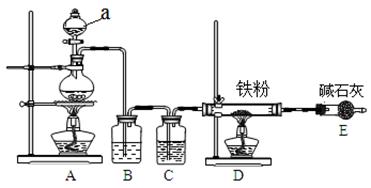
①装置A中仪器a的名称是___________。
②装置B的作用是______________,C中的试剂______________。
③实验开始时先点燃____处酒精灯;装置E的作用为________________________。
(2)工业上制备无水氯化铁的一种工艺流程如下: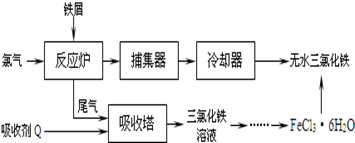
①吸收塔中发生反应的离子方程式为_________________________________________。
②简述由FeCl3·6H2O晶体得到无水氯化铁的操作:______________________________。
③用碘量法测定所得无水氯化铁的质量分数:称取m克无水氯化铁样品,溶于稀盐酸,再转移到100 mL容量瓶中,用蒸馏水定容;取出10 mL,加入稍过量的KI溶液,充分反应后,滴入指示剂_________(填试剂名称),用c mol/L的Na2S2O3溶液进行滴定,终点时消耗V mLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)。则样品中氯化铁的质量分数为____________。
④某同学根据上述方案,使用上述(2)中获得的FeCl3•6H2O样品代替无水氯化铁样品进行测定,通过计算发现产品中的质量分数大于100%,其原因可能是____________________。
有一白色固体粉末可能是碳酸钠、亚硫酸钠、硫酸钠中的一种或二种或三者都有,某兴趣小组拟对该样品进行探究。
(1)取少量样品溶解于水,测定溶液的pH,若测得溶液的pH>7,可以得出的结论是:
;
(2)如果要检验该样品不含有硫酸钠,请简要说明检验的方法、现象和结论:
________________________________________________________________________;
(3)如果由于实验过程中某种原因,导致固体在空气中停留时间过长,用盐酸和氯化钡检验出硫酸根,能确定有硫酸钠吗? (能或不能),为什么?
(4)若想在(2)的基础上验证是否存在碳酸钠、亚硫酸钠,请按下列要求完成实验过程:
①实验过程中所用的试剂:
②实验过程
| 实验步骤 |
现象和结论 |
| … |
… |