乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的结构简式为 ,A的官能团为 (填名称)。
(2)下列物质中,不能通过乙烯加成反应得到的是 (填序号)。
| A.CH3CH3 | B.CH3CHCl2 | C.CH3CH2OH | D.CH3CH2Br |
(3)已知2CH3CHO+O2 2CH3COOH若以乙烯为主要原料合成乙酸,其合成路线如下图所示:
2CH3COOH若以乙烯为主要原料合成乙酸,其合成路线如下图所示:
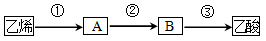
a.反应②的化学方程式为 。
b.工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为 ,反应类型是 。
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
| 编号 |
H2C2O4溶液 |
酸性KMnO4溶液 |
温度/℃ |
||
| 浓度/mol•L-1 |
体积/mL |
浓度/mol•L-1 |
体积/mL |
||
| ① |
0.10 |
2.0 |
0.010 |
4.0 |
25 |
| ② |
0.20 |
2.0 |
0.010 |
4.0 |
25 |
| ③ |
0.20 |
2.0 |
0.010 |
4.0 |
50 |
(1)该反应的离子方程式为;
(2)探究温度对化学反应速率影响的实验编号是(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是;
(3)实验①测得KMn04溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMn04)=mol·L-1·min-1;
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时c(Mn04-)~t的变化曲线示意图。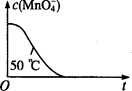
[化学—选修:化学与技术]三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:
(1)氯化水解法生产三氯氧磷的化学方程式为。
(2)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是(选填字母),滴定终点的现象为。
a.NH4Fe(SO4)2 b.FeCl2 c.甲基橙 d.淀粉②实验过程中加入硝基苯的目的是,如无此操作所测Cl元素含量将会(填“偏大”、“偏小”或“不变”)
(3)氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水。在废水中先加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。
①在沉淀前先加入适量漂白粉的作用是。
②下图是不同条件对磷的沉淀回收率的影响图像。
处理该厂废水最合适的工艺条件为(选填字母)。
a.调节pH=9 b.调节pH=10 c.反应时间30 min d.反应时间120 min
③若处理后的废水中c(PO43-)=4×10-7 mol·L-1,溶液中c(Ca2+)=mol·L-1。(已知Ksp[Ca3(PO4)2]=2×10-29)
(15分)I、用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+ CO2(g)+2H2O(g)△H= 574 kJ·moll
②CH4(g)+4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g)△H= 1160 kJ·moll
③H2O(l)=H2O(g)△H=+44kJ·moll
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式___。
II、开发新能源和三废处理都是可持续发展的重要方面。CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
(1)M、N两点平衡状态下,容器中物质的总物质的量之比为:n(M)总:n(N)总=。
(2)若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为;P1P2 (填“>” 或“<” 或“=”)
III、用MnO2制KMnO4的工艺流程如下图:电解池中两极材料均为碳棒,在中性或酸性溶液中K2MnO4发生歧化反应而变成MnO2和KMnO4。
(1)写出240℃熔融时发生反应的化学方程式;投料时必须满足n(KOH):n(MnO2)。
(2)阳极的电极反应式为。
(3)B物质是(填化学式),可以循环使用的物质是(填化学式)。
有M、N两种溶液,经测定这两种溶液中大量存在下列12种离子:Al3+、Cl-、Na+、K+、NO3—、OH-、Fe2+、AlO2—、CO32—、NH4+、SO42—、H+。
(1)完成下列表格中实验①的结论和实验②的实验内容以及现象:
| 实验内容以及现象 |
结论 |
| ①取少量N溶液滴加足量的硝酸钡溶液,无沉淀产生 |
|
| ② |
确定M溶液中含有Na+,不含K+ |
| ③用pH试纸检测M溶液,pH试纸呈蓝色 |
(2)根据(1)中的实验回答:
NO3—存在于________溶液中,理由是;
Cl-存在于________溶液中,理由是;
(3)根据(1)中的实验确定,M溶液中含有的离子为。
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含氰废水中的CN-有剧毒。
①CN-中C元素显+2价, N元素显-3价,用原子结构解释N元素显负价的原因是,共用电子对偏向N原子,N元素显负价。
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为。
(2)含乙酸钠和对氯酚(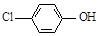 )的废水可以利用微生物电池除去,其原理如下图所示。
)的废水可以利用微生物电池除去,其原理如下图所示。
①B是电池的极(填“正”或“负”);
②A极的电极反应式为。
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A- 表示乳酸根离子)。
阳极的电极反应式为。
简述浓缩室中得到浓乳酸的原理:。
③ 电解过程中,采取一定的措施可控制阳极室的pH约为6-8,此时进入浓缩室的OH-可忽略不计。400mL 10 g•L-1乳酸溶液通电一段时间后,浓度上升为145 g•L-1(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为L。(乳酸的摩尔质量为90 g• mol-1)