1.52g 铜镁合金完全溶解于50mL密度为1.4g·cm—3、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol·L—1NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
| A.该合金中铜与镁的物质的量之比是2:1 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54 g沉淀时,加入NaOH溶液的体积是600mL |
与下列图像有关的说法正确的是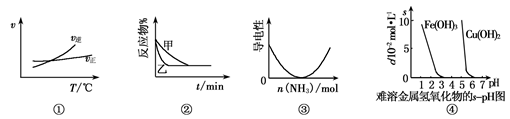
A根据图①可判断A2(g)+3B2(g)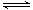 2AB3(g)的ΔH>0
2AB3(g)的ΔH>0
B.图②表示压强对2A(g)+B(g)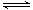 3C(g)的影响,甲的压强大
3C(g)的影响,甲的压强大
C.图③表示乙酸溶液中通入氨气后溶液导电性的变化
D.根据图④,调节溶液的pH 为4即可除去CuSO4溶液中的Fe3+
已知25℃时,弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10ˉ5,Ka(HSCN)=0.13。在物质的量浓度均为0.1 mol·Lˉ1的CH3COONa和NaSCN混合溶液中,下列排序正确的是
| A.c(OHˉ)>c(CH3COOH )>c(HSCN )>c(H+) |
| B.c(OHˉ)>c(HSCN )>c(CH3COOH )>c(H+) |
| C. c(OHˉ)>c(SCNˉ)>c(CH3COOˉ)>c(H+) |
| D. c(OHˉ)>c(CH3COOˉ)>c(SCNˉ)>c(H+) |
将铜丝烧热,迅速插入氢气中,发生反应:CuO+H2 Cu+H2O。若用下列物质代替氢气进行上述实验:①一氧化碳、②稀硝酸、③稀盐酸、④乙醇,铜丝表面所观察到的现象、铜丝质量变化情况与上述实验完全相同的是
Cu+H2O。若用下列物质代替氢气进行上述实验:①一氧化碳、②稀硝酸、③稀盐酸、④乙醇,铜丝表面所观察到的现象、铜丝质量变化情况与上述实验完全相同的是
| A.①②③ | B.①④ | C.①③④ | D.只有① |
下列实验推理中,正确的是
| A.实验时剩余的药品不能放回原瓶,所以实验时剩余的白磷也不能放回原瓶 |
| B.某种气体通入品红溶液中,品红褪色,该气体一定是SO2 |
| C.焰色反应时观察到黄色火焰,说明样品中一定含钠元素可能含钾元素 |
| D.将铜片放入浓硫酸中,无明显现象,说明铜在冷浓硫酸中发生钝化 |
设NA为阿伏加德罗常数,下列说法正确的是
| A.5.6 g金属铁与足量盐酸反应时,失去0.3NA个电子 |
| B.100 mL 1 mol·Lˉ1的NaHCO3溶液含有0.1NA个CO32ˉ |
| C.标准状况下,2.24 L37Cl2中含有4NA个中子 |
| D.25℃时,1 L pH=1的稀硫酸溶液中含有0.2NA个H+ |