(1)相对分子质量为72的烷烃的分子式是_____________,
(2)该烷烃在空气中燃烧的化学反应方程式是 ,
(3)它可能的结构简式是 。
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈(填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” )。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈,溶液中c(Na+) c(CH3COO-)。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈,醋酸体积氢氧化钠溶液体积。
石油化工的重要原料CxHy可以合成很多有机化合物,以下是CxHy合成物质E和J的流程图: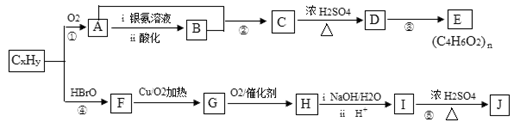
已知:Ⅰ.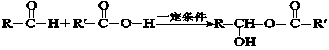 (反应中R、R′代表烃基)
(反应中R、R′代表烃基)
Ⅱ.J的分子式为C4H4O4 ,是一种环状化合物。
(1)在CxHy的同系物中,所有碳原子一定共平面且碳原子数最多的分子的名称是______。
(2)H的分子式是,CxHy的电子式为
(3)下列说法正确的是。
| A.CxHy和苯都能使溴水褪色,原理相同 |
| B.反应②和反应④的反应类型均为加成反应 |
| C.C能与Na、NaOH、NaHCO3反应 |
| D.E是一种水溶性很好的高分子化合物 |
E.J在酸性或碱性环境中均能水解
(4)K是J的同分异构体,且1 mol K与足量的NaHCO3溶液反应可放出2mol CO2气体,请写出一种符合条件K的结构简式__。
(5)写出反应⑤的化学方程式______。
(6)D有多种同分异构体,与D具有相同官能团的还有种(含顺反异构体),其中核磁共振氢谱有3组吸收峰,且能发生银镜反应的结构简式是。
碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) =4NO(g)+CO2(g) + 2H2O(g)ΔH1=-574 kJ·molˉ1
CH4(g) + 4NO(g) = 2N2(g)+CO2(g) + 2H2O(g)ΔH2
若2 mol CH4 还原NO2 至N2,整个过程中放出的热量为1734 kJ,则ΔH2=;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为:Fe2O3(s) + 3CH4(g) 2Fe(s) + 3CO(g) +6H2(g)⊿H>0
2Fe(s) + 3CO(g) +6H2(g)⊿H>0
①若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为________________。
②若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是__________
A.CH4的转化率等于CO的产率
B.混合气体的平均相对分子质量不变
C.v(CO)与v(H2)的比值不变
D.固体的总质量不变
③该反应达到平衡时某物理量随温度变化如图所示,当温度由T1升高到T2时,平衡常数KAKB(填“>”、“<”或“=”)。纵坐标可以表示的物理量有哪些。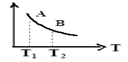
A.H2的逆反应速率
B.CH4的的体积分数
C.混合气体的平均相对分子质量
D.CO的体积分数
(3)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2 2NH3,该过程中还原反应的方程式为。
2NH3,该过程中还原反应的方程式为。
(4)若往20mL 0.0lmol·L-l的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法正确的是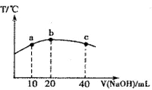
①该烧碱溶液的浓度为0.02mol·L-1
②该烧碱溶液的浓度为0.01mol·L-1
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO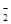 )>c(OH
)>c(OH )> c(H+)
)> c(H+)
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是其它化学知识的载体。
(1)从以上元素中选择,在自然界中有游离态存在的有元素(填元素符号)。
(2)离子交换膜是一类具有离子交换功能的高分子材料。一容器被离子交换膜分成左右两部分,如图所示。
若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),一段时间后可观察到的现象:右边(从下列选项中选择)
| A.无明显现象 | B.溶液由浅绿色变红色 |
| C.溶液由无色变黄色 | D.溶液由浅绿色变无色 |
左边发生反应的离子方程式:;
若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2mol NH4Al(SO4)2的溶液,右边充满含3mol Ba(OH)2的溶液,当有2mol SO42-通过交换膜时(若反应迅速完全),则左右两室沉淀的物质的量之比为。
(3)某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,利用相关工艺可进行提纯与综合利用。通入一定量的N2后,在1500℃下与Cl2充分反应得到纯化石墨与气体混合物,然后降温至80℃,分别得到不同状态的两类物质a和b。(注:石墨中氧化物杂质均转变为相应的氯化物,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃。)
①若a与过量的NaOH溶液反应,可得两种盐,其中一种盐的水溶液具有粘合性,化学反应方程式为。
②若b与过量的NaOH溶液充分反应后,过滤,所得滤液中阴离子有____________;
然后向滤液中继续加适量乙酸乙酯并加热可得沉淀,写出生成沉淀的离子方程式_____。
(14分)某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32ˉ、SO42ˉ、SiO32ˉ、NO中的一种或几种离子,取该溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。
请回答下列问题:
(1)由强酸性条件即可判断溶液X中一定不存在的离子有 ;
(2)溶液X中,关于NO3-的判断一定正确的是;
A一定有B.一定没有C.可能有
(3)产生气体A的离子方程式为;
(4)转化⑥发生反应的现象为;
(5)转化④中产生H的离子方程式为;
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为;
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液①NaOH溶液 ②KSCN溶液 ③石蕊试剂 ④pH试纸 ⑤KMnO4溶液 ⑥氯水和KSCN的混合溶液中的一种,根据现象即可判断,该试剂最好是。