工业上用亚硫酸氢钠(NaHSO3)与碘酸钠(NaIO3)反应制备单质碘。试配平该反应的化学方程式,并标出电子转移的总数及方向。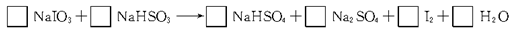
配位键是一种特殊的共价键,即共用电子对由某原子单方面提供和另一提供空轨道的粒子结合。如NH就是由NH3(氮原子提供电子对)和H+(提供空轨道)通过配位键形成的。据此,回答下列问题:
(1)下列粒子中可能存在配位键的是
| A.CO2 | B.H3O+ | C.CH4 | D.[Ag(NH3)2] + |
(2)向硫酸铜溶液中滴加氨水,会有蓝色沉淀产生,继续滴加,沉淀溶解,溶液变成深蓝色。请写出沉淀溶解的离子方程式。
(3)配位化学创始人维尔纳发现,将各为1mol的CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)、CoCl3·4NH3(绿色)、CoCl3·4NH3(紫色)四种配合物溶于水,加入足量硝酸银溶液,生成氯化银沉淀分别为3mol、2mol、1mol、和1mol。已知上述配合物中配离子的配位数均为6。请根据实验事实用配合物的形式写出它们的化学式。
①CoCl3·5NH3②CoCl3·4NH3(紫色)
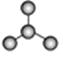
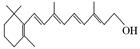
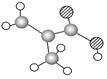
A B C
(1)图A是由4个碳原子结合成的某种烷烃(氢原子没有画出)。
①写出该有机物的系统命名法的名称。②该有机物的同分异构体的核磁共振氢谱中应有个峰
(2)图B的键线式表示维生素A的分子结构。
①该分子的化学式为。②1 mol维生素A最多可与mol H2发生加成反应。
(3)某物质只含C、H、O三种元素,其分子模型如图C所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。
①该物质的结构简式为
②该物质中所含官能团的名称为和
从以下6种物质中选取序号填空(仅填序号,可重复选填)。
①二氧化碳;②硫化氢;③氯化铵;④氢氧化钾;⑤乙炔;⑥乙醇
(1)含有非极性键的是;
(2)既含有σ键又含有π键的是;
(3)含有配位键的是;
(4)分子的立体结构呈V形的是;
(5)属于非极性分子的是;
(6)属于离子化合物的是。
已知:CH3—CH=CH2+HBr→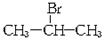 (主要产物),1 mol某芳香烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A在不同条件下能发生如下面所示的一系列变化。
(主要产物),1 mol某芳香烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A在不同条件下能发生如下面所示的一系列变化。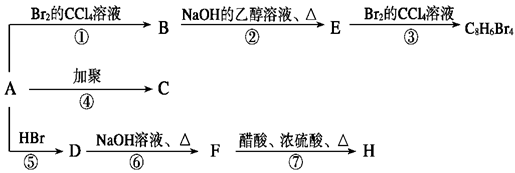
(1)A的结构简式:。
(2)上述反应中,①是反应,⑦是反应。(填反应类型)
(3)写出C,E物质的结构简式:C, E,
(4)写出D→F反应的化学方程式。
某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为;
(2)A中的碳原子是否都处于同一平面?(填“是”或“不是”);
(3)已知A、B、C有如下转化关系: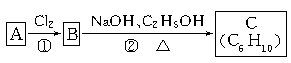
则反应②的化学方程式为;C的化学名称是。