用化学术语回答下列问题:
(1)书写电离方程式:氢氟酸 ;
(2)书写水解离子方程式:硫酸铝 ;
(3)电解硝酸银溶液电极反应式(惰性电极)①阳极: ;②阴极: .
写出下列叙述中有关物质的结构简式;分子式为C3H7Br的卤代烃经消去反应后得到的有机物是_________________________;能与金属钠反应,但不能与氢氧化钠反应的芳香族化合物C7H8O是___________________;含C、H、O三种元素的有机物,燃
烧时消耗的氧气和生成的CO2、H2O之间物质的量之比为1:2:2,则此类有机物中最简单的一种是________________
化合物A为一种常见金属元素与一种常见非金属元素组成的化合物,阳离子与阴离子的个数比为2:3。K为常见固态非金属单质,J为常见气态单质。其余为化合物,其中I、F在常温下为液态, C为臭鸡蛋气味气体,D为刺激性气体,H无色无味气体,B为白色胶状沉淀,L为氯碱工业中的常见产品。F的浓溶液与K加热可生成D和H。(部分生成物未标出)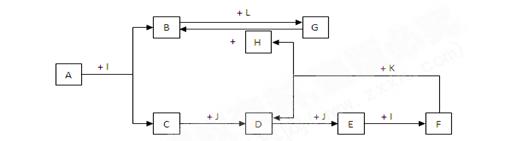
(1)写出H的电子式
(2)写出下列物质的化学式: EJ
(3)写出下列变化的化学方程式:
A + I → B + C
F的浓溶液与K加热可生成D和H
(4)写出下列变化的离子方程式:
B中加入L的水溶液
G的水溶液中通入过量的H
今有一无色的混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、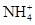 、Cl-
、Cl-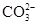 、
、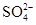 ,现取两份100 mL溶液进行如下实验:①第一份加过量NaOH溶液加热后,只收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。②在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g。③第二份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65 g。根据上述实验回答:
,现取两份100 mL溶液进行如下实验:①第一份加过量NaOH溶液加热后,只收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。②在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g。③第二份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65 g。根据上述实验回答:
(1)一定不存在的离子是________________
(2)不能确定是否存在的离子是
(3)试确定K+是否存在________(填“是”或“否”),判断的理由是
.(8分)在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示。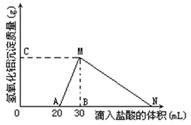
问:(1)此溶液中同时含有____mol___离子;
(2)用离子方程式表示MN段发生的反应是
(3)C(或M)点的纵坐标为0.78,则c(AlO2-)
(4)点B的横坐标为30,则到点N处滴入的HCl溶液体积为mL
(2分) 相对分子质量为M的某物质在室温下的溶解度为S g,此时测得饱和溶液的密度为ρg·cm-3,则该饱和溶液的物质的量浓度是