有关元素X、Y、Z、D、E的信息如下
| 元素 |
有关信息 |
| X |
元素主要化合价为—2,原子半径为0.074nm |
| Y |
所在主族序数与所在周期序数之差为4 |
| Z |
原子半径为0.102nm,核外最外层电子数是其电子层数的2倍,其单质在X的单质中燃烧,产生的气体通入品红中,品红褪色。 |
| D |
最高价氧化物对应的水化物,是强电解质,能电离出电子数相等的阴、阳离子 |
| E |
单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
请回答下列问题:
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为 。
(2)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号) 。
①保存EY2溶液时,需向溶液加入少量E单质
②通常实验室配制EY3溶液时,直接用水溶解EY3固体即可
③EY2只能通过置换反应生成,EY3只能通过化合反应生成
④铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
(3)用电子式表示D2Z的形成过程: ,D2Z水溶液显 性用离子方程式表示其原因 。
(4)2009年3月,墨西哥、美国等多国连接暴发甲型H1N1型流感,防控专家表示,含Y消毒剂和过氧化物可防甲型H1N1流感。YO2是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KYO3在H2ZO4存在下与D2ZO3反应制得。请写出反应的离子方程式: 。
(5)将一定量的Y单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含Y元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。

该苛性钾溶液中KOH的质量是 g,该反应中转移电子的物质的量是 mol。
有A、B、C、D四种溶液,它们是烧碱、硫酸、碳酸氢铵、氯化铜溶液中的某一种。各取少量,将其两两混合,其中A、B混合有蓝色絮状沉淀生成, C 与足量B或D混合均有无色气体产生。根据题意回答下列问题:
(1)B、C分别是、
(2)向A中滴加B,离子方程式:
向C中滴加D,离子方程式:
(3)少量B和C混合,现象:________,离子方程式:_______________________________。
(4)上述三个反应均属于________________反应(填基本反应类型),反应发生的条件的不同点是;相同点是。
(1)将ag氯化钙溶于1.8L水中,恰好使钙离子数与水分子数之比为1:100,则a值为 。
(2)在反应2A+B=3C+2D中,已知3.4gA与3.2gB完全反应,生成4.8gC,又知道D的式量为18,则B的式量是
(3)25.4g 某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是 ;A的相对原子质量是;ACl2的化学式是。
(4) 某混合物由Na2SO4、Al2(SO4)3组成,已知Na、Al两元素的质量之比为23: 9,则Na2SO4和Al2(SO4)3物质的量之比为,含1.00mol SO42–的该混合物的质量为。
常温下KMnO4氧化浓HCl的反应方程式如下:2KMnO4 +16HCl(浓)=2KCl+2MnCl 2+5Cl 2↑+8H2O
(1)用“双线桥法”标明反应中电子转移的方向和数目。
(2)又已知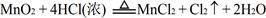 ,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是:。
,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是:。
(3)若有63.2g高锰酸钾参加反应,则被氧化的HCl的物质的量为mol,产生的Cl2在标准状况下的体积为L。
某溶液甲中可能含有下列离子中的几种:K+、NO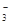 、SO
、SO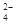 、NH
、NH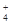 、CO
、CO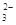 (不考虑溶液中由水电离的少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
(不考虑溶液中由水电离的少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为672mL;
实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g。
(1)甲溶液中一定存在的离子是;
(2)甲溶液中一定不存在的离子是;
(3)甲溶液中可能存在的离子是;你得出此结论的理由是。
某工厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红(Fe2O3)和氧化铜。(已知铜能溶解在稀硝酸中生成硝酸铜溶液)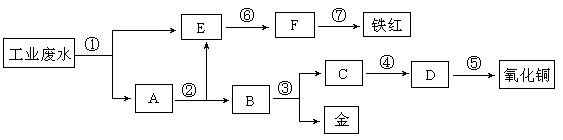
请填写下面空白:
(1)图中标号处需加入的相应物质分别是(填化学式)①②
③④;
(2)A处固体成分为(填化学式)
(3)写出⑤处反应的化学方程式;